题目内容
4. 维生素B2也称“核黄素”,其结构如下图.维生素B2的磷酸盐衍生物是某些氧化还原酶的辅基,为生长必需物质,缺少维生素B2会引起口角炎、皮肤和眼部疾病.下列有关维生素B2的说法中正确的是( )
维生素B2也称“核黄素”,其结构如下图.维生素B2的磷酸盐衍生物是某些氧化还原酶的辅基,为生长必需物质,缺少维生素B2会引起口角炎、皮肤和眼部疾病.下列有关维生素B2的说法中正确的是( )| A. | 核黄素晶体属于离子晶体 | B. | 核黄素能发生银镜反应 | ||
| C. | 核黄素能被酸性高锰酸钾溶液氧化 | D. | 核黄素能与氯化铁溶液作用呈紫色 |
分析 由有机物的结构简式判断分子式,分子中含有C=N,可发生加成、氧化反应,含有羟基,可发生取代、氧化和消去反应,含有 ,可发生水解,以此解答该题.
,可发生水解,以此解答该题.
解答 解:A.有机物属于共价化合物,不含由离子键,不是离子化合物,故A错误;
B.有机物不含醛基,不发生银镜反应,故B错误;
C.含有羟基,可被酸性高锰酸钾氧化,故C正确;
D.分子中不含酚羟基,与氯化铁不发生显色反应,故D错误.
故选C.
点评 本题考查有机物的结构和性质,是高考中的常见题型和重要的考点之一,属于中等难度的试题,试题基础性强,侧重对学生能力的培养和解题方法的指导,该题的关键是准确判断出分子中含有的官能团,然后依据相应官能团的结构和性质,灵活运用即可,有利于培养学生的知识迁移能力和辑推理能力.

练习册系列答案
相关题目
14.图表归纳是学习化学的一种常用方法.下列某同学归纳的表与图中对应关系正确的是( )
| 选项 | X | Y | Z | 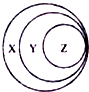 |
| A | 胶体 | 分散系 | 淀粉溶液 | |
| B | 强电解质 | 强酸 | 硫酸 | |
| C | 化合物 | 酸性氧化物 | 非金属氧化物 | |
| D | 离子反应 | 复分解反应 | 酸与盐的反应 |
| A. | A | B. | B | C. | C | D. | D |
12.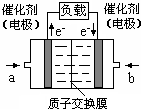 可给笔记本电脑供电的甲醇燃料电池已经面世,其结构示意图如下.甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一电极后与氧气反应,电池总反应为:2CH3OH+3O2=2CO2+4H2O.下列说法不正确的是( )
可给笔记本电脑供电的甲醇燃料电池已经面世,其结构示意图如下.甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一电极后与氧气反应,电池总反应为:2CH3OH+3O2=2CO2+4H2O.下列说法不正确的是( )
 可给笔记本电脑供电的甲醇燃料电池已经面世,其结构示意图如下.甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一电极后与氧气反应,电池总反应为:2CH3OH+3O2=2CO2+4H2O.下列说法不正确的是( )
可给笔记本电脑供电的甲醇燃料电池已经面世,其结构示意图如下.甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一电极后与氧气反应,电池总反应为:2CH3OH+3O2=2CO2+4H2O.下列说法不正确的是( )| A. | 右电极为电池正极,b处通入的物质是空气 | |
| B. | 左电极为电池负极,a处通入的物质是空气 | |
| C. | 负极反应式为:CH3OH+H2O-6e-=CO2+6H+ | |
| D. | 正极反应式为:O2+4H++4e-=2H2O |
19.一定温度下,某在物质水中的溶解度为S,计算该温度下这种饱和溶液中溶质的物质的量浓度,必不可少的物理量是 ( )①溶液中溶质的摩尔质量②溶液中溶质和溶剂的质量比③溶液的密度④溶液的体积.
| A. | ①② | B. | ②③ | C. | ①③ | D. | ②④ |
9.下列有关胶体和溶液的比较中,正确的是( )
| A. | 溶液中溶质粒子不带电,胶体分散质粒子带电 | |
| B. | 溶液中溶质的粒子运动有规律,胶体粒子运动无规律 | |
| C. | 通直流电后,溶液中溶质的粒子分别向两极运动,而胶体中分散质的粒子向某一极运动 | |
| D. | 溶液中通过一束光线没有特殊现象,胶体中通过一束光线出现光亮的“通路” |
16.在室温下,由水电离出的C(H+)=10-12mol/L的溶液中,下列离子组可大量共存的是( )
| A. | K+、ClO-、SO42-、I- | B. | S2-、SO32-、Na+、K+ | ||
| C. | Fe2+、NO3-、Cl-、K+ | D. | AlO2-、MnO4-、Fe2+、Na+ |
13.下列操作不正确的是( )
| A. | 配制物质的量浓度的溶液,在定容时滴加蒸馏水超过刻度线,可用滴管吸出一部分使其溶液的凹液面与刻度线相切 | |
| B. | 过滤的时候,用玻璃棒引流,并将玻璃棒与三层滤纸的边缘接触 | |
| C. | 试管中滴加溶液时,不能将滴管伸入试管口内,应悬空滴入 | |
| D. | 蒸发氯化钠溶液,待蒸发皿中有大量固体出现时,停止加热,用余热蒸干 |
14.目前,消除氮氧化物污染有多种方法.
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染.已知:
①CH4 (g)+4NO2 (g)=4NO(g)+CO2 (g)+2H2 O(g)△H=-574kJ•mol-1
②CH4 (g)+4NO(g)=2N2 (g)+CO2 (g)+2H2 O(g)△H=-1160kJ•mol-1
③H2O(g)=H2O(l)△H=-44.0kJ•mol-1
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(l)的热化学方程式
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(1),△H=-955kJ•mol-1.
(2)用活性炭还原法处理氮氧化物.有关反应为:C(s)+2NO(g)?N2 (g)+CO2 (g)某研究小组向
恒容密闭容器加入一定量的活性炭和NO,恒温条件下反应,反应进行到不同时间测得各物质的浓度如下
①不能作为判断反应达到化学平衡状态的依据是BC
A.容器内CO2的浓度保持不变 B.v正(N2)=2v正(NO)
C.容器内压强保持不变 D.混合气体的密度保持不变
E.混合气体的平均相对分子质量保持不变
②在该温度下时.该反应的平衡常数为0.56(保留两位小数);
③在30min,改变某一条件,反应重新达到平衡,则改变的条件是分离出了二氧化碳.
(3)甲烷燃料电池可以提升能量利用率,下图是利用甲烷燃料电池电解50mL2mol/L的氯化铜溶液的
装置示意图:
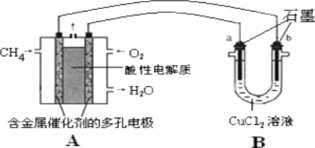
请回答:
①甲烷燃料电池的负极反应式是CH4-8e-+10OH-=CO32-+7H2O
②当A中消耗0.15mol氧气时,B中b(用a或b 表示)极增重6.4g.
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染.已知:
①CH4 (g)+4NO2 (g)=4NO(g)+CO2 (g)+2H2 O(g)△H=-574kJ•mol-1
②CH4 (g)+4NO(g)=2N2 (g)+CO2 (g)+2H2 O(g)△H=-1160kJ•mol-1
③H2O(g)=H2O(l)△H=-44.0kJ•mol-1
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(l)的热化学方程式
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(1),△H=-955kJ•mol-1.
(2)用活性炭还原法处理氮氧化物.有关反应为:C(s)+2NO(g)?N2 (g)+CO2 (g)某研究小组向
恒容密闭容器加入一定量的活性炭和NO,恒温条件下反应,反应进行到不同时间测得各物质的浓度如下
| 浓度/mol•L-1 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
A.容器内CO2的浓度保持不变 B.v正(N2)=2v正(NO)
C.容器内压强保持不变 D.混合气体的密度保持不变
E.混合气体的平均相对分子质量保持不变
②在该温度下时.该反应的平衡常数为0.56(保留两位小数);
③在30min,改变某一条件,反应重新达到平衡,则改变的条件是分离出了二氧化碳.
(3)甲烷燃料电池可以提升能量利用率,下图是利用甲烷燃料电池电解50mL2mol/L的氯化铜溶液的
装置示意图:

请回答:
①甲烷燃料电池的负极反应式是CH4-8e-+10OH-=CO32-+7H2O
②当A中消耗0.15mol氧气时,B中b(用a或b 表示)极增重6.4g.