题目内容
【题目】![]() 是一种重要的化学原料,在生产和生活中应用十分广泛。
是一种重要的化学原料,在生产和生活中应用十分广泛。
(1)氯水中![]() 具有漂白性,能杀菌消毒。其电子式为_____________。
具有漂白性,能杀菌消毒。其电子式为_____________。
(2)实验室可用![]() 和浓盐酸反应制取
和浓盐酸反应制取![]() ,反应的离子方程式是_________。
,反应的离子方程式是_________。
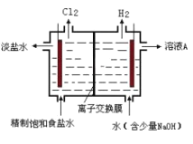
(3)工业上可采取电解饱和食盐水的方法制取![]() ,装置如图所示,图中的离子交换膜为_______(填“阳”或“阴”)离子交换膜。
,装置如图所示,图中的离子交换膜为_______(填“阳”或“阴”)离子交换膜。
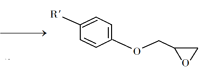
(4)以![]() 为原料,用
为原料,用![]() 氧化制取
氧化制取![]() ,可提高效益,减少污染。反应如下:
,可提高效益,减少污染。反应如下:![]()
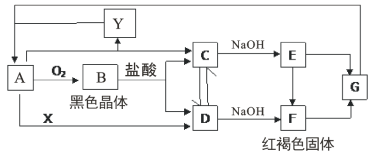
上述反应在同一反应器中,通过控制合适条件,分两步循环进行,可使![]() 转化率接近100%,其基本原理如下图所示:
转化率接近100%,其基本原理如下图所示:
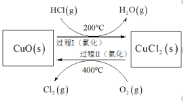
过程Ⅰ的反应为:![]()
![]()
①过程Ⅱ反应的热化学方程式为_______________。
②过程Ⅰ流出的气体通过稀![]() 溶液(含少量酚酞)进行检测,氯化初期主要为不含
溶液(含少量酚酞)进行检测,氯化初期主要为不含![]() 的气体,判断氯化结束时溶液的现象为___________。
的气体,判断氯化结束时溶液的现象为___________。
③相同条件下,若将氯化温度升高的300℃。溶液中出现上述现象的时间将缩短,其原因为______。
④实验测得在不同压强下,总反应的![]() 平衡转化率
平衡转化率![]() 随温度变化的曲线如图;
随温度变化的曲线如图;
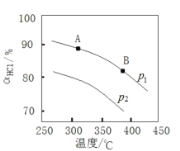
i 平衡常数比较:K(A)_________K(B)(填“>”“<”或“=”)。
ii 压强比较:p1_______p2 。(填“>”“<”或“=”)
【答案】![]() 2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O 阳 2CuCl2(s)+O2(g)═2CuO(s)+2Cl2(g) △H2=+125.4kJmol1 溶液由红色变为无色(或溶液红色变浅) 温度升高,反应速率加快,且氯化程度减少 > >
2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O 阳 2CuCl2(s)+O2(g)═2CuO(s)+2Cl2(g) △H2=+125.4kJmol1 溶液由红色变为无色(或溶液红色变浅) 温度升高,反应速率加快,且氯化程度减少 > >
【解析】
(1)氯水中的![]() 为共价化合物,结合共价化合物成键方式书写;
为共价化合物,结合共价化合物成键方式书写;
(2)实验室可用![]() 和浓盐酸反应生成氯化锰、氯气和水;
和浓盐酸反应生成氯化锰、氯气和水;
(3)电解饱和食盐时阳极阴离子Cl-、OH-放电,Cl-的放电能力强于OH-,阳极发生的方程式为:2Cl--2e-═Cl2↑,阴极:2H++2e-═H2↑;H2、NaOH在阴极;
(4)①根据盖斯定律计算;
②氯化初期不含氯化氢气体,所以稀NaOH溶液(含少量酚酞)变红,后期含氯化氢与氢氧化钠中和碱性减弱;
③温度越高反应速率越快,氯化的时间缩短;
④i正反应是放热反应,温度越高平衡常数越小;
ii正反应是气体体积缩小的反应,所以增大压强平衡正向移动;
(1) 氯水中![]() 为共价化合物,其电子式为
为共价化合物,其电子式为![]() ;
;
(2) 实验室可用![]() 和浓盐酸反应生成氯化锰、氯气和水,反应的离子方程式是 2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O;
和浓盐酸反应生成氯化锰、氯气和水,反应的离子方程式是 2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O;
(3)电解槽中阴极是氢离子放电生成氢气,阳极发生的方程式为:2Cl--2e-═Cl2↑,阴极:2H++2e-═H2↑,水电离平衡正向进行氢氧根离子浓度增大,则电解池中Na+透过交换膜与OH-结合,生成氢氧化钠,A溶液为浓度较大的NaOH溶液,由此可得图中的离子交换膜为阳离子交换膜;
(4)①根据盖斯定律4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g) △H=115.4 kJmol1①;2HCl(g)+CuO (s)CuCl2(s)+H2O(g) △H1=120.4kJmol1②,所以①2×②得:2CuCl2(s)+O2(g)═2CuO (s)+2Cl2(g) △H2=+125.4 kJmol1;
2Cl2(g)+2H2O(g) △H=115.4 kJmol1①;2HCl(g)+CuO (s)CuCl2(s)+H2O(g) △H1=120.4kJmol1②,所以①2×②得:2CuCl2(s)+O2(g)═2CuO (s)+2Cl2(g) △H2=+125.4 kJmol1;
②氯化初期不含氯化氢气体,所以稀NaOH溶液(含少量酚酞)变红,后期含氯化氢与氢氧化钠中和碱性减弱,所以现象为溶液由红色变为无色(或溶液红色变浅);
③温度越高,反应速率越快,氯化的时间缩短;
④i正反应是放热反应,温度越高平衡常数越小,因为T(B)>T(A),所以平衡常数K(A)>K(B);
ii正反应是气体体积缩小的反应,所以增大压强平衡正向移动,相同温度下p1对应的HCl平衡转化率大,所以p1>p2。

【题目】短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法正确的是
X | Y | ||||
Z | W | Q |
A.元素Q位于第3周期VII族
B.原子半径的大小顺序为rX>rY>rZ>rW>rQ
C.离子![]() 和
和![]() 的核外电子排布相同
的核外电子排布相同
D.元素Y的最高正化合价为6
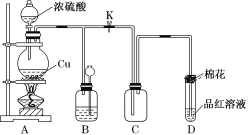
【题目】某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、乙酸。

已知:①无水氯化钙可与乙醇形成微溶于水的CaCl2·6C2H5OH;
②有关有机物的沸点:
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
请回答:
(1)圆底烧瓶中发生的化学反应方程式:________,浓硫酸的作用为________。
(2)球形干燥管C的作用是_________,D中放________溶液,其作用是________。
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出____________;再加入(此空从下列选项中选择)__________;然后进行蒸馏,收集77℃左右的馏分,以得到较纯净的乙酸乙酯。
A.生石灰B.碱石灰C.无水硫酸钠