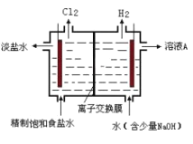
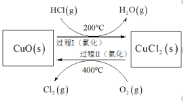
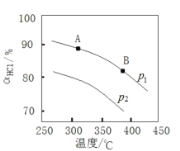
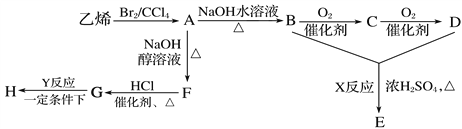
题目内容
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法正确的是
X | Y | ||||
Z | W | Q |
A.元素Q位于第3周期VII族
B.原子半径的大小顺序为rX>rY>rZ>rW>rQ
C.离子![]() 和
和![]() 的核外电子排布相同
的核外电子排布相同
D.元素Y的最高正化合价为6
【答案】C
【解析】
根据短周期元素X、Y、Z、W、Q在元素周期表中的相对位置,可以推知X为N元素,Y为O元素,Z为Al元素,W为S元素,Q为Cl元素。
A.元素Q属于主族元素,位于第3周期VIIA族,A错误;
B.电子层数越多半径越大,电子层数相同时核电荷数越大半径越小,故原子半径大小顺序为rZ>rW>rQ>rX>rY,B错误;
C.离子![]() 和
和![]() 的核外电子数均为10,电子排布相同,C正确;
的核外电子数均为10,电子排布相同,C正确;
D.氧元素无最高正价,D错误;
答案选C。

 名校课堂系列答案
名校课堂系列答案【题目】下列有关实验的仪器选择和部分实验操作均正确的是( )
选项 | 实验 | 所选主要仪器铁架台等忽略 | 部分操作 |
A | 用浓硫酸配制480mL0.1mol/L硫酸溶液 | 500mL容量瓶、烧杯、玻璃棒、量筒、胶头滴管 | 将刚稀释所得的硫酸溶液立刻转移至500mL容量瓶,并加水至刻度线即可 |
B | 从食盐水中得到NaCl晶体 | 坩埚、酒精灯、玻璃棒、泥三角、三脚架 | 当加热至大量晶体出现时,停止加热,利用余热继续蒸干 |
C | 从碘的四氯化碳溶液中得到碘 | 蒸馏烧瓶、酒精灯、温度计、冷凝管、锥形瓶、牛角管 | 温度计水银球插入液液面以下 |
D | 用汽油提取溴水中的Br2 | 分液漏斗、烧杯 | 分离时下层液体从分液漏斗下口放出,上层液体从上口倒出 |
A.AB.BC.CD.D
【题目】某实验小组探究![]() 和
和![]() 的反应规律。实验操作及现象如下:
的反应规律。实验操作及现象如下:
实验及试剂 | 编号 | 无色 | 试管中溶液颜色 | 淀粉KI试剂颜色 |
| 1 | 0.5mL | 浅黄色 | 无色 |
2 | 0.20mL | 深黄色 | 无色 | |
3 | 0.25mL | 浅黄色 | 蓝色 | |
4 | 0.30mL | 无色 | 蓝色 |
(1)取实验2后的溶液,进行如下实验:

经康康同学检验,上述白色沉淀是![]() 。写出加入0.20mL
。写出加入0.20mL ![]() 后,溶液中
后,溶液中![]() 和
和![]() 发生反应的离子方程式:____________。
发生反应的离子方程式:____________。
(2)查阅资料:一定条件下,![]() 和
和![]() 都可以被氧化成
都可以被氧化成![]() 。
。
作出假设:![]() 溶液用量增加导致溶液褪色的原因是过量的
溶液用量增加导致溶液褪色的原因是过量的![]() 溶液与(1)中的反应产物继续反应,同时生成
溶液与(1)中的反应产物继续反应,同时生成![]() 。进行实验:
。进行实验:
①取少量实验4中的无色溶液进行以下实验,进一步佐证其中含有![]() 。
。

其中试剂X可以是_________(填字母序号)。
a 碘水 b ![]() 溶液 c
溶液 c ![]() 溶液 d
溶液 d ![]() 溶液
溶液
②李政同学提出,仅通过润湿淀粉![]() 试纸变蓝的现象不能说明生成
试纸变蓝的现象不能说明生成![]() ,理由是_______,便补充了如下实验:将实验4中的湿润淀粉
,理由是_______,便补充了如下实验:将实验4中的湿润淀粉![]() 试纸替换为________,在滴加
试纸替换为________,在滴加![]() 溶液后,发现________,进一步佐证实验4中生成了
溶液后,发现________,进一步佐证实验4中生成了![]() 。
。