题目内容
【题目】25℃时,用HCl气体或NaOH固体调节0.01mol·L-1二元酸(以H2A表示)溶液的pH(忽略溶液体积的变化),溶液中H2A、HA-、A2-、H+、OH-浓度的对数值(lgc)变化如下图所示:

下列说法错误的是
A. 25℃时,H2A的Ka1数量级为10-2
B. pH=1.2时,调节溶液pH用的是HCl气体
C. pH=7时,溶液中:c(Na+)=c(HA-)+c(A2-)
D. pH=8时,溶液中:c(A2-)>c(HA-)>c(H2A)
【答案】C
【解析】
二元酸H2A溶液存在电离平衡H2A![]() H++HA-、HA-
H++HA-、HA-![]() H++A2-,向溶液中通入HCl气体或加入NaOH固体,平衡发生移动,pH发生改变,溶液中H2A、HA-、A2-、H+、OH-浓度也发生改变,以此分析解答。
H++A2-,向溶液中通入HCl气体或加入NaOH固体,平衡发生移动,pH发生改变,溶液中H2A、HA-、A2-、H+、OH-浓度也发生改变,以此分析解答。
A. 由图可知,pH=1.2时,c(H2A)=c(HA-),根据H2A![]() H++HA-,Ka1=
H++HA-,Ka1=![]() =c(H+)=10-1.2=100.8×10-2,所以Ka1数量级为10-2,故A正确;
=c(H+)=10-1.2=100.8×10-2,所以Ka1数量级为10-2,故A正确;
B. H2A溶液存在电离平衡H2AH++HA-、HA-H++A2-,以第一步电离为主,故在H2A溶液中,c(H+)与c(HA-)近似相等。由图可知,pH=1.2时,c(H+) >c(HA-)> c(A2-),应是溶液中通入了HCl,所以调节溶液pH用的是HCl气体,故B正确;
C. pH=7时,溶液呈中性,调节溶液pH用的是NaOH固体,c(H+)=c(OH-),根据电荷守恒:c(Na+)+ c(H+)=c(HA-)+2c(A2-)+ c(OH-),所以c(Na+)=c(HA-)+2c(A2-),故C错误;
D. 由图可知,pH=8时,溶液中:c(A2-)>c(HA-)>c(H2A),故D正确。
答案选C。

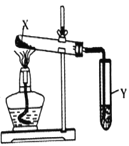
【题目】按图装置进行实验,下列现象能推断出结论的是( )
选项 | 试剂X | Y中试剂及现象 | 结论 | 装置 |
A | 一种盐 | 酚酞溶液未变红 | 该盐不可能是铵盐 |
|
B | 小苏打和纯碱 | 石灰水变浑浊 | 纯碱比小苏打稳定 | |
C | 氢氧化钙与氯化铵 | 硝酸银溶液中先产生沉淀后溶解 | Ag2O能溶于氨水 | |
D | 氯酸钾与二氧化锰 | 淀粉、碘化钾和和硫酸的混合溶液变蓝 | 反应产生了Cl2 |
A. A B. B C. C D. D