题目内容
某学习小组按右图在实验室制取氨气并探究铜的有关性质(部分夹持仪器未画出)。请回答: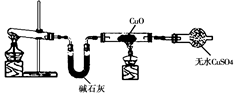
(1)制取氨气的化学方程式是 。
(2)① 实验现象为:黑色CuO变为红色(生成单质a);白色无水CuSO4粉末变为蓝色; 同时生成一种无色气体,该气体无污染。请写出氨气与CuO反应的化学方程式 。
②碱石灰的作用是 。
(3)将上述生成的单质a在热水浴中进行4个实验,部分实验报告如下表所示。
| 序号 | 实验操作 | 实验现象 |
| Ⅰ | 稀硫酸中加入该单质a | 无明显变化 |
| Ⅱ | 硝酸钠溶液中加入该单质a | 无明显变化 |
| Ⅲ | 硫酸钠溶液中加入该单质a | 无明显变化 |
| Ⅳ | 稀硫酸中加入硝酸钠溶液 | 无明显变化 |
| 再加入该单质a | 有无色气泡;溶液变蓝 |
②实验Ⅳ中反应的本质是(用离子方程式表示) 。
(每空2分,共10分) (1)Ca(OH)2+2NH4Cl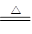 CaCl2+2H2O+2NH3↑
CaCl2+2H2O+2NH3↑
(2)①3CuO +2NH3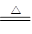 3Cu+N2+3H2O ②吸收氨气中混有的水蒸气,防止干扰产物的鉴定。
3Cu+N2+3H2O ②吸收氨气中混有的水蒸气,防止干扰产物的鉴定。
(3)①说明钠离子、硫酸根离子、硝酸根离子均不能单独使铜溶解
②3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O
解析试题分析:(1)制取氨气的化学方程式是Ca(OH)2+2NH4Cl CaCl2+2H2O+2NH3↑。
CaCl2+2H2O+2NH3↑。
(2)①黑色CuO变为红色(生成单质a),则a是铜。白色无水CuSO4粉末变为蓝色,这说明反应中有水生成。同时生成一种无色气体,该气体无污染,则根据原子守恒可知,该气体是氮气,所以氨气与CuO反应的化学方程式是3CuO +2NH3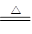 3Cu+N2+3H2O。
3Cu+N2+3H2O。
②由于生成的氨气中含有水蒸气,而水蒸气会干扰实验,因此碱石灰的作用是吸收氨气中混有的水蒸气,防止干扰产物的鉴定。
(3)①根据实验过程可知,实验I、II、III是实验Ⅳ的对照实验,所以实验I、II、III的目的是说明钠离子、硫酸根离子、硝酸根离子均不能单独使铜溶解。
②根据实验现象可知,在酸性条件下,硝酸钠能氧化单质铜,反应的离子方程式是3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O。
考点:考查氨气的制备、氨气性质的检验以及氧化还原反应的有关判断和应用
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生实验能力的培养和解题方法的指导,有助于培养学生规范、严谨的实验设计和评价能力。该类试题主要是以实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确性及灵活运用知识解决实际问题的能力。

某学习小组按右图在实验室制取氨气并探究铜的有关性质(部分夹持仪器未画出)。
请回答:
(1)制取氨气的化学方程式是 。
(2)① 实验现象为:黑色CuO变为红色(生成单质a);白色无水CuSO4粉末变为蓝色; 同时生成一种无色气体,该气体无污染。请写出氨气与CuO反应的化学方程式 。 ②碱石灰的作用是 。
(3)将上述生成的单质a在热水浴中进行4个实验,部分实验报告如下表所示。
| 序号 | 实验操作 | 实验现象 |
| Ⅰ | 稀硫酸中加入该单质a | 无明显变化 |
| Ⅱ | 硝酸钠溶液中加入该单质a | 无明显变化 |
| Ⅲ | 硫酸钠溶液中加入该单质a | 无明显变化 |
| Ⅳ | 稀硫酸中加入硝酸钠溶液 | 无明显变化 |
| 再加入该单质a | 有无色气泡;溶液变蓝 |
②实验Ⅳ中反应的本质是(用离子方程式表示) 。
③将该单质a加入到混有硫酸的过氧化氢溶液中,溶液逐渐变成蓝色,该反应的离子方程式是 。
某学习小组按右图在实验室制取氨气并探究铜的有关性质(部分夹持仪器未画出)。
请回答:

(1)制取氨气的化学方程式是 。
(2)① 实验现象为:黑色CuO变为红色(生成单质a);白色无水CuSO4粉末变为蓝色; 同时生成一种无色气体,该气体无污染。请写出氨气与CuO反应的化学方程式 。 ②碱石灰的作用是 。
(3)将上述生成的单质a在热水浴中进行4个实验,部分实验报告如下表所示。
|
序号 |
实验操作 |
实验现象 |
|
Ⅰ |
稀硫酸中加入该单质a |
无明显变化 |
|
Ⅱ |
硝酸钠溶液中加入该单质a |
无明显变化 |
|
Ⅲ |
硫酸钠溶液中加入该单质a |
无明显变化 |
|
Ⅳ |
稀硫酸中加入硝酸钠溶液 |
无明显变化 |
|
再加入该单质a |
有无色气泡;溶液变蓝 |
①实验I、II、III的目的是 。
②实验Ⅳ中反应的本质是(用离子方程式表示) 。
③将该单质a加入到混有硫酸的过氧化氢溶液中,溶液逐渐变成蓝色,该反应的离子方程式是 。
某学习小组按右图在实验室制取氨气并探究铜的有关性质(部分夹持仪器未画出)。请回答:
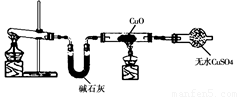
(1)制取氨气的化学方程式是 。
(2)① 实验现象为:黑色CuO变为红色(生成单质a);白色无水CuSO4粉末变为蓝色; 同时生成一种无色气体,该气体无污染。请写出氨气与CuO反应的化学方程式 。
②碱石灰的作用是 。
(3)将上述生成的单质a在热水浴中进行4个实验,部分实验报告如下表所示。
|
序号 |
实验操作 |
实验现象 |
|
Ⅰ |
稀硫酸中加入该单质a |
无明显变化 |
|
Ⅱ |
硝酸钠溶液中加入该单质a |
无明显变化 |
|
Ⅲ |
硫酸钠溶液中加入该单质a |
无明显变化 |
|
Ⅳ |
稀硫酸中加入硝酸钠溶液 |
无明显变化 |
|
再加入该单质a |
有无色气泡;溶液变蓝 |
①实验I、II、III的目的是 。
②实验Ⅳ中反应的本质是(用离子方程式表示) 。
某学习小组按右图在实验室制取氨气并探究铜的有关性质(部分夹持仪器未画出)。
请回答:
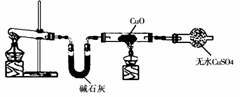
(1)制取氨气的化学方程式是
。
(2)① 实验现象为:黑色CuO变为红色
(生成单质a);白色无水CuSO4粉末
变为蓝色; 同时生成一种无色气体,
该气体无污染。
请写出氨气与CuO反应的化学方程式 。
②碱石灰的作用是 。
(3)将上述生成的单质a在热水浴中进行4个实验,部分实验报告如下表所示。
| 序号 | 实验操作 | 实验现象 |
| Ⅰ | 稀硫酸中加入该单质a | 无明显变化 |
| Ⅱ | 硝酸钠溶液中加入该单质a | 无明显变化 |
| Ⅲ | 硫酸钠溶液中加入该单质a | 无明显变化 |
| Ⅳ | 稀硫酸中加入硝酸钠溶液 | 无明显变化 |
| 再加入该单质a | 有无色气泡;溶液变蓝 |
①实验I、II、III的目的是 。
②实验Ⅳ中反应的本质是(用离子方程式表示) 。
③将该单质a加入到混有硫酸的过氧化氢溶液中,溶液逐渐变成蓝色,该反应的离子方程式是 。