题目内容
(1)已知在常温常压下:
①CH3CH2OH(l)+3O2(g) 2CO2(g)+3H2O(g) ΔH1=-1366kJ·mol-1
2CO2(g)+3H2O(g) ΔH1=-1366kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) ΔH2
③H2O(g)=H2O(l) ΔH3=-44kJ·mol-1
④CH3CH2OH(l)+2O2(g) 2CO(g)+3H2O(l) ΔH4=-932kJ·mol-1
2CO(g)+3H2O(l) ΔH4=-932kJ·mol-1
则 CO的燃烧热 ΔH =_________。
在图中画出,不同温度下(T1>T2),上述反应④中O2的平衡转化率随压强变化的关系图(请在图上标注温度T1、T2)。_________

(3)一定条件下,在体积为3 L的密闭容器中反应CO(g) + 2H2(g) CH3OH(g)达到化学平衡状态。
CH3OH(g)达到化学平衡状态。
①反应的平衡常数表达式K=__________;根据下图,升高温度,K值将___________(填“增大”、“减小”或“不变”)。
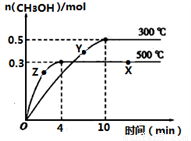
②500℃时,从反应开始到达到化学平衡,以H2的浓度变化表示的化学反应速率是________。
③X点与Y点的平均速率:v(X)_________v(Y);其中X点的正反应速率v正(X)与Z点的逆反应速率v逆(Z)的大小关系为v正(X)________v逆(Z)(填“>”、“<”、“=”)。
④300℃时能够说明该可逆反应达到化学平衡状态的标志是____________ (填字母)。
a.v生成(CH3OH) = v生成(H2) b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变 d.CO、H2、CH3OH的浓度相等
⑤500℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是___________。(填字母)
a.c(H2)减少 b.正反应速率加快,逆反应速率减慢
c.CH3OH 的百分含量增加 d.重新平衡时c(H2)/ c(CH3OH)减小
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案软锰矿的主要成分为MnO2,含少量Al2O3和SiO2。闪锌矿主要成分为ZnS,含少量FeS、CuS、CdS杂质。现以软锰矿和闪锌矿为原料制备MnO2和Zn,其简化流程如下(中间产物的固体部分已经略去)。
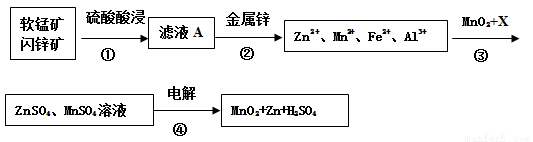
已知: Ⅰ.矿石中所有金属元素在滤液A中均以离子形式存在。
Ⅱ.各种金属离子完全沉淀的pH如下表:
Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
回答下列问题:
(1)步骤①中为了加快硫酸的浸取速率,可采用的方法是_________________(任写一种)。①中发生多个反应,其中MnO2、FeS与硫酸共热时有淡黄色物质析出,溶液变为棕黄色,写出MnO2、FeS与硫酸共热发生反应的化学方程式______________________。
(2)步骤②加入金属锌是为了回收金属,回收金属的主要成分是_________。
(3)步骤③中MnO2的其作用是__________________,另外一种物质X可以是__________。
A.ZnO B.MgCO3 C.MnCO3 D.Cu(OH)2
(4)MnO2与Li构成LiMnO2,它可作为某锂离子电池的正极材料,电池反应方程式为: Li1-xMnO2+LixC6=LiMnO2+6C,写出该锂离子电池的正极电极反应式__________。
(5)已知:HCN的电离常数K=4.9×10-10,H2S的电离常数K1=1.3×10―7,K2=7.0×10―15,向NaCN溶液中通入少量的H2S气体,反应的离子方程式为__________________。在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含有0.020 mol·L―1Mn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS―浓度为1.0×10―4 mol·L―1时,Mn2+开始沉淀,则a=______。[已知:Ksp(MnS)=1.4×10―15]
25℃时,5种银盐的溶度积常数(Ksp)分别是:
AgCl | Ag2SO4 | Ag2S | AgBr | AgI |
1.8×10-10 | 1.4×10-5 | 6.3×10-50 | 7.7×10-13 | 8.51×10-16 |
下列说法正确的是
A. 氯化银、溴化银和碘化银的溶解度依次增大
B. 将硫酸银溶解于水后,向其中加入少量硫化钠溶液,不能得到黑色沉淀
C. 在5mL1.8×10-5 mol/L的NaCl溶液中,加入1滴(1mL约20滴)1.0×10-3 mol/L的AgNO3溶液,能观察到白色沉淀
D. 将浅黄色溴化银固体浸泡在饱和氯化钠溶液中,可以有少量白色固体生成窗体顶端
用沉淀法测定 KHCO3和 Na2CO3 固体混合物的组成,每次称取一定质量的样品溶于水制成溶液,向其中滴加相同浓度的 Ba(OH)2 溶液,每次实验均充分反应,反应前后溶液体积变化忽略不计,实验记录见下表:
实验序号 | I | II | III | IV | Ⅴ |
样品质量(g) | 3.06 | 6.12 | 9.18 | 12.24 | 15.30 |
Ba(OH)2溶液体积(mL) | 300 | 300 | 300 | 300 | 300 |
生成沉淀的质量(g) | 5.91 | 11.82 | 17.73 | 23.64 | 23.64 |
回答下列问题:
(1)样品中KHCO3 和Na2CO3 的物质的量之比_______。
(2)室温下第III组实验所得溶液中的 OH-物质的量浓度为_________。
下列物质的分离提纯方法选择不正确的是
A | 除去氯化钠溶液中的泥沙 | 过滤 |
B | 用四氯化碳提取溴水中的溴 | 萃取 |
C | 分离乙酸(沸点 118℃ )与乙酸乙酯(沸点 77℃ ) | 分液 |
D | 从含有少量氯化钠的硝酸钾溶液中提取硝酸钾 | 结晶 |
A. A B. B C. C D. D


 CO32-+H3O+加水稀释后,H+浓度减小
CO32-+H3O+加水稀释后,H+浓度减小