题目内容
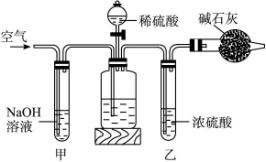
纯碱中常含有少量的NaCl等杂质,利用下图仪器装置可用来测定纯碱中Na2CO3的质量分数。
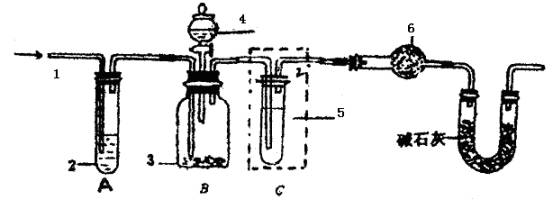
图中:1.空气 2.某溶液 3.纯碱 4.稀硫酸 6.碱石灰
其实验步骤是:
a.按上图所示,组装好实验仪器,并检查其气密性;
b.准确称量盛有碱石灰的干燥管D的质量(设为m1 g);
c.准确称量一定量的纯碱(设为n g);并将其放进广口瓶内;
d.从分液漏斗中缓缓滴入一定量稀硫酸,并从“1”处缓缓鼓入空气,至B反应器中不再产生气体为止。
e.准确称量干燥管D的总质量(设为m2 g)。
根据上述实验,回答下列问题:
(1)该实验进行至操作d时,要缓缓鼓入空气,鼓入空气的作用是 。装置A中盛装的液体“2”应选用 ;装置A的作用是 。如果撤去装置A,直接向装置B中缓缓鼓入空气,则会导致实验测定结果 (填偏大、偏小和不变)。
(2)在空白格内画出装置C及试剂;装置C盛放的试剂“5”是 ;说明装置C的作用是 ;如果撤去装置C,则会导致实验测定结果 。(填偏大、偏小和不变)
(3)根据此实验,计算纯碱中Na2CO3的质量分数的数学式为 (用m1、m2、n表示)。
(4)装置E的作用是 。
解析:
(1)把反应器B中产生的二氧化碳气体送入干燥管D中;NaOH溶液;除去空气中的二氧化碳;偏大 (2)浓硫酸;干燥二氧化硫(吸水);偏大 (3) (4)防止空气中水蒸气、二氧化碳气体进入干燥管D
|
提示:
本实验的目的是测定纯碱样品中碳酸钠的纯度。主要反应在装置B中进行。纯碱与稀硫酸反应产生的二氧化碳,通入D中会使D中的碱石灰增重,通过称量装置D中碱石灰的质量变化,即可测知产生二氧化硫的量,从而计算出样品中碳酸钠的质量和质量分数。 (1)为了将稀硫酸和纯碱样品反应产生的二氧化碳气体送入干燥管中,在实验进行至操作d时,要缓缓鼓入空气,但空气中含有二氧化碳,所以在空气进入装置B之前,应用氢氧化钠溶液除去其中的二氧化碳,故A中所盛溶液为氢氧化钠。如果撤去A装置,空气中的二氧化碳会随着装置B中产生的二氧化碳一起进入干燥管D,从而导致结果偏大。 (2)由于纯碱样品与稀硫酸反应时,可能产生水蒸气,如果水蒸气随着产生的二氧化碳进入干燥管D,会导致测定结果偏大,所以应在C中加入干燥剂进行干燥。由于二氧化碳是酸性气体,应选择浓硫酸作干燥剂。 (3)通过称量干燥管D中碱石灰的质量变化,即吸收的二氧化碳的质量,根据以下关系,即可求出碳酸钠质量,从而求出样品的纯度。 Na2CO3 ~ CO2 106 44 x m2-m1
碳酸钠的纯度为 (4)干燥管D右端也可能有空气进入,装置E中的碱石灰可以吸收空气中的二氧化碳和水蒸气,防止其进入D影响测定结果。 错因分析:A中盛有的液体选用澄清的石灰水。因为氢氧化钙在水中的溶解度很小,不能确保将二氧化碳除净。
|

 名校课堂系列答案
名校课堂系列答案 工业生产的纯碱中常含有少量的NaCl杂质.某校研究性学习活动小组为了测定混合物中纯碱的质量分数,拟使用如图实验装置(说明:连接甲和乙的橡皮管有铁夹控制),先测定一定量的样品和酸反应放出二氧化碳的质量,再计算混合物中纯碱的质量分数.
工业生产的纯碱中常含有少量的NaCl杂质.某校研究性学习活动小组为了测定混合物中纯碱的质量分数,拟使用如图实验装置(说明:连接甲和乙的橡皮管有铁夹控制),先测定一定量的样品和酸反应放出二氧化碳的质量,再计算混合物中纯碱的质量分数.
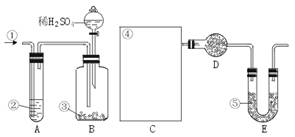 其实验步骤是:a.按上图所示,组装好实验仪器,并检查其气密性。b.准确称量盛有碱石灰的干燥管D的质量(设为m1 g)。c.准确称量一定量的纯碱(设为n g),并将其放入广口瓶内。d.从分液漏斗中缓慢滴入一定量的稀硫酸,并从“1”处缓慢鼓入空气,直到B容器中不再产生气体为止。e.准确称量干燥管D的总质量(设为m2 g)。
其实验步骤是:a.按上图所示,组装好实验仪器,并检查其气密性。b.准确称量盛有碱石灰的干燥管D的质量(设为m1 g)。c.准确称量一定量的纯碱(设为n g),并将其放入广口瓶内。d.从分液漏斗中缓慢滴入一定量的稀硫酸,并从“1”处缓慢鼓入空气,直到B容器中不再产生气体为止。e.准确称量干燥管D的总质量(设为m2 g)。