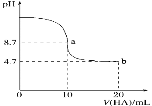
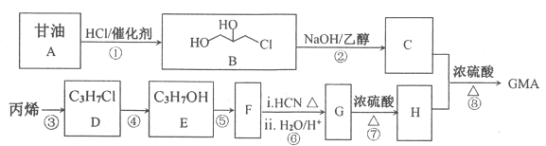
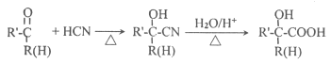
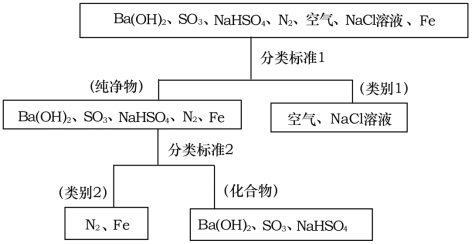
题目内容
【题目】下列有关![]() 和
和![]() 混合溶液的叙述正确的是( )
混合溶液的叙述正确的是( )
A. 向该溶液中加入浓盐酸,每产生![]() ,转移电子约为
,转移电子约为![]() 个
个
B. 该溶液中,![]() 可以大量共存
可以大量共存
C. 滴入少量![]() 溶液,反应的离子方程式为:
溶液,反应的离子方程式为:![]()
D. 为验证![]() 的水解,用
的水解,用![]() 试纸测该溶液的
试纸测该溶液的![]()
【答案】A
【解析】
A.发生Cl-+ClO-+2H+=Cl2↑+H2O,由反应可知,生成1mol气体转移1mol电子,则转移电子约为6.02×1023个,A正确;
B.Ag+、Cl-结合生成沉淀,且乙醛易被ClO-氧化,不能共存,B错误;
C. NaClO为强碱弱酸盐,水解呈碱性,NaCl为中性,溶液中不存在大量的氢离子,离子方程式为2Fe2++ClO-+H2O=Fe3++Fe(OH)3↓+Cl-,C错误;
D.ClO-的水解使溶液显碱性,使pH试纸显蓝色,但ClO-具有强的氧化性,又会使变色的试纸氧化为无色,因此不能用pH测定该溶液的的pH,D错误;
故合理选项是A。

练习册系列答案
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案
相关题目