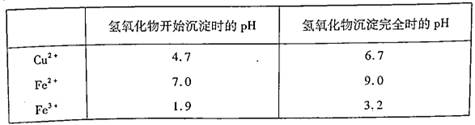
题目内容
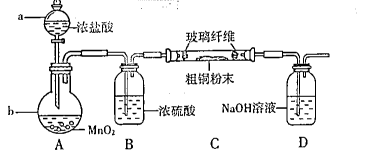
某校课外活动小组同学设计实验,探究木炭与浓硫酸在加热条件下反应生成气体的成分。
【实验探究】
(1)木炭与浓硫酸反应的化学方程式:C+2H2SO4(浓) CO2↑+2SO2↑+2H2O,其中浓H2 S04所起的作用是 (填“氧化剂”或“还原剂”)。若有0.2mol碳的完全反应,则消耗H2S04的质量是 g,标况下产生SO2的体积为______________L。
CO2↑+2SO2↑+2H2O,其中浓H2 S04所起的作用是 (填“氧化剂”或“还原剂”)。若有0.2mol碳的完全反应,则消耗H2S04的质量是 g,标况下产生SO2的体积为______________L。
(2)A装置中品红溶液颜色 (填“褪色”或“不褪色”),证明含有 气体。
(3)实验过程中,装置C将观察到的现象是_______________________________。
【实验讨论】
(4)有同学对B装置能否除尽SO2气体有疑义。你认为应该在B、C装置之间连接右图中 装置,以确认SO2是否除尽。
【联系实际】
(5)煤和石油的燃烧过程中都有二氧化硫和二氧化碳排放,其中二氧化硫造成的环境影响主要是_________,二氧化碳造成的环境影响主要是_______。(每空格只填一个选项)
A.酸雨 B.破坏臭氧层 C.温室效应
(14分)
(1)氧化剂(1分) 39.2 (2分) 8.96(2分)
(2)褪色(1分) SO2(或二氧化硫)(2分)
(3)石灰水变浑浊(2分)
(4)a (2分)
(5)A C (每空1分,共2分)
解析试题分析:(1)浓H2 SO4中硫化合价降低,作氧化剂,0.2mol碳的完全反应,则消耗H2S04的质量是0.4mol×98g/mol=39.2g;标况下产生SO2的体积为0.4mol×22.4L/mol=8.96 L,答案:氧化剂(1分) 39.2 (2分) 8.96(2分)
(2)A装置中品红溶液颜色褪色,说明有SO2中生成。答案:褪色(1分), SO2(或二氧化硫)(2分)
(3)B将SO2除去后,装置C将观察到的现象石灰水变浑浊,说明有CO2生成,答案:石灰水变浑浊(2分)
(4)应该在B、C装置之间连接a装置,用来证明SO2已经除尽,答案:a (2分)
(5)SO2主要是形成酸雨,CO2主要是形成温室效应,答案:A C (每空1分,共2分)
考点:碳、浓硫酸的性质实验

某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:
(1)仪器a的名称为________;仪器b中可选择的试剂为________;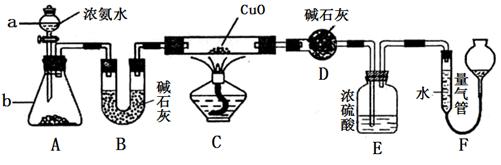
(2)实验室中利用下列各组物质,进行喷泉实验,不能成功的是( )
| A.Cl2与饱和食盐水 | B.CO2 与40%的NaOH溶液 |
| C.NH3与饱和食盐水 | D.HCl与水 |
(4)E装置中浓硫酸的作用_______________________
(5)实验完毕,若测得干燥管D增重mg,装置F测得气体的体积为nL(已折算成标准状况),则氨分子中氮、氢的原子个数比为________(用含m、n字母的代数式表示)
某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:
(1) 仪器a的名称为________;仪器b中可选择的试剂为________;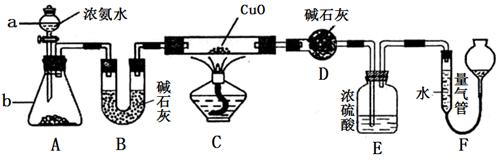
(2)实验室中利用下列各组物质,进行喷泉实验,不能成功的是 。
| A.Cl2与饱和食盐水 | B.CO2 与40%的NaOH溶液 |
| C.NH3与饱和食盐水 | D.HCl与水 |
(4)E装置中浓硫酸的作用________________________________。
(5)实验完毕,若测得干燥管D增重mg,装置F测得气体的体积为nL(已折算成标准状况),则氨分子中氮、氢的原子个数比为________(用含m、n字母的代数式表示)。
某化学兴趣小组的同学利用下图所示实验装置进行实验(图中a、b、c表示止水夹)。
|
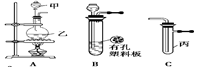
 请按要求填空:
请按要求填空:(1)利用B装置可制取的气体有 (填2种)。
A、C、E相连后的装置可用于制取Cl2并进行相关的性质实验。
若在丙中加入适量水,即可制得氯水。将所得氯水分成两份,进行Ⅰ、Ⅱ两个实验,实验操作、现象结论如下:
| 实验序号 | 实验操作 | 现象 | 结论 |
| Ⅰ | 将氯水滴入品红溶液 | 溶液褪色 | 氯气与水反应的产物有漂白性 |
| Ⅱ | 氯水中加入 NaHCO3粉末 | 有无色气泡产生 | 氯气与水反应的产物具有较强的酸性 |
(2)请你评价实验Ⅰ、Ⅱ的结论是否合理?若不合理,请说明理由。
。
(3)请利用上述A、C装置设计一个简单的实验,验证Cl2和Br2的氧化性强弱(分别指出甲、乙、丙中盛装的试剂、实验现象及结论)
。
B、D、E装置相连后,在B中盛装足量浓硝酸和铜片(放在有孔塑料板上),可制得NO2并进行有关实验。
(4)B中发生反应的化学方程式为 。
(5)欲用D装置验证NO2与水的反应,其操作步骤为:先关闭止水夹 ,再打开止水夹 ,使烧杯中的水进入试管丁的操作是
。
(6)试管丁中的NO2与一定量的O2混合后倒插水中,试管9/10充满水,则原试管丁中的混合气体的平均分子量可能为 。(保留二位小数)
化学美无处不在,下图是物质间发生化学反应的颜色变化,其中X是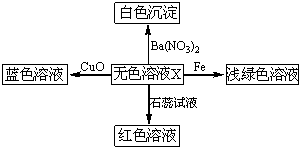
| A.稀盐酸 | B.Na2SO4溶液 | C.稀硫酸 | D.Na2CO3溶液 |

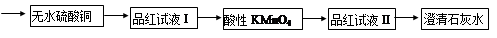
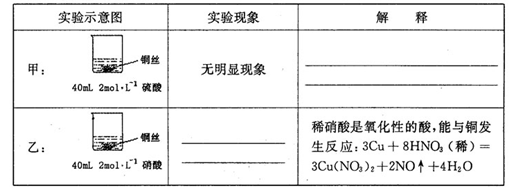
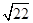 =0.7)
=0.7)