题目内容
【题目】随原子序数递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。

根据判断出的元素回答问题:
(1)f在周期表中的位置是________________。
(2)比较d、e常见离子的半径大小(用化学式表示,下同):________>________;比较g、h的最高价氧化物对应水化物的酸性强弱:______________。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式:________________。
Ⅱ.4种相邻主族短周期元素的相对位置如表,元素x的原子核外电子数是m的2倍,y的氧化物具有两性。
m | n | ||
x | y |
回答下列问题:
(1)元素x在周期表中的位置是第________周期、第________族。
(2)m、n、y三种元素最高价氧化物的水化物中,酸性最强的是________,碱性最强的是________(填化学式)。
【答案】 第三周期第ⅢA族 r(O2-) r(Na+) HClO4>H2SO4  、H∶CC∶H等其他合理答案均可) 三 ⅡA HNO3 Al(OH)3
、H∶CC∶H等其他合理答案均可) 三 ⅡA HNO3 Al(OH)3
【解析】Ⅰ.根据图中八种短周期元素原子半径的相对大小,最高正价或最低负价的变化,判断出x是H,y是C,z是N,d是O,e是Na,f是Al,g是S,h是Cl。则
(1)f是Al,在元素周期表中位于第三周期第ⅢA族。(2)O2-和Na+的核外电子排布相同,核电荷数越大,半径越小,故离子半径r(O2-)>r(Na+);元素的非金属性越强,最高价氧化物对应水化物的酸性越强,非金属性:Cl>S,故酸性:HClO4>H2SO4。(3)八种短周期元素组成的四原子共价化合物有NH3、H2O2、C2H2等,它们的电子式分别为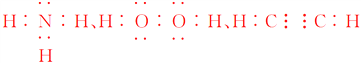 等。
等。
Ⅱ. 4种短周期元素,y的氧化物具有两性推出y为铝元素,根据4种元素在周期表中的相对位置,可知x为镁元素,m为碳元素,n为氮元素。则
(1)x为镁元素,在元素周期表位于第三周期第ⅡA族;(2)非金属性越强,最高价氧化物水化物的酸性越强,m、n、y三种元素最高价氧化物的水化物依次为H2CO3、HNO3和Al(OH)3,则酸性最强的是HNO3,碱性最强的是Al(OH)3。

 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案 高效智能课时作业系列答案
高效智能课时作业系列答案【题目】NiSO46H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有Cu、Fe、Cr等杂质)为原料获得.工艺流程如图:
已知:25℃时,几种金属氢氧化物的溶度积常数和完全沉淀的pH范围如下表所示.
Fe(OH)2 | Fe(OH)3 | Cr(OH)3 | Ni(OH)2 | |
Ksp | 8.0×10-16 | 4.0×10-38 | 6.0×10-31 | 6.5×10-18 |
完全沉淀pH | ≥9.6 | ≥3.2 | ≥5.6 | ≥8.4 |
请回答下列问题:
(1)下列措施可行,且能提高废渣浸出率的有___________。
A.升高反应温度
B.增大压强
C.在反应过程中不断搅拌
(2)在滤液Ⅰ中加入6%的H2O2 , 其作用是(用离子方程式表示);加入NaOH调节pH的范围是 , 为了除去溶液中的离子.
(3)滤液Ⅱ的主要成分是 .
(4)操作Ⅰ的实验步骤依次为:
①;
②向沉淀中滴加稀H2SO4 , 直至恰好完全溶解 ;
③蒸发浓缩、冷却结晶,过滤得NiSO46H2O晶体;
④用少量乙醇洗涤NiSO46H2O晶体并晾干。


