��Ŀ����
����Ŀ����98%��Ũ����(���ܶ�Ϊ1.84g/cm3)����100mL 1.0molL��1ϡ���ᣬ
(1)����ȡŨ��������Ϊ_____mL��
(2)������Һʱ��һ����Է�Ϊ���¼������裺����ȡ �ڼ��� ���ܽ� �ܵߵ�ҡ�� ��ת�� ��ϴ�� �߶��� ����ȴ������ȷ�IJ���˳��Ϊ________________����ʵ������õ�����������Ͳ�����������ձ�����ͷ�ιܡ�����___________��
(3)�����ƹ����У����в���������Ũ��ƫ�ߵ���____����Ӱ�����____(�����)��
��û��ϴ���ձ��Ͳ�������
��ת����Һʱ������������������ƿ���棻
������ƿ�����������������ˮ��
�ܶ���ʱ���ӿ̶��ߣ�
��δ��ȴ�����¾ͽ���Һת�Ƶ�����ƿ�����ݣ�
���ݺ�����ƿ������ҡ�ȣ����ú�Һ����ڿ̶��ߣ��ټ�ˮ���̶��ߡ�
���𰸡�5.4mL �ڢ٢ۢ�ݢޢߢ� 100mL����ƿ �ܢ� ��
��������
��1������c=![]() �����Ũ�����Ũ�ȣ�����ϡ��ǰ�����ʵ������䣬�������ҪŨ����������
�����Ũ�����Ũ�ȣ�����ϡ��ǰ�����ʵ������䣬�������ҪŨ����������
��2������һ�����ʵ���Ũ�ȵ���Һ�����ƹ��̼�����Ҫ���������в����������������ȷ����
��3������c=![]() ������������
������������
��1��![]() ��ϡ��ǰ�����ʵ������䣬
��ϡ��ǰ�����ʵ������䣬
![]() ��
��![]() ��
��![]() ��
��![]() ��
��
��2��������Һʱ�IJ��������㡢��ȡ���ܽ⡢��ȴ��ת�ơ�ϴ�ӡ����ݡ�ҡ�ȣ�����ȷ����˳��Ϊ���ڢ٢ۢ�ݢޢߢܣ���ʵ���и�������������Ͳ�����������ձ�����ͷ�ι��⣬����Ҫ100mL����ƿ��
��3����û��ϴ���ձ��Ͳ����������ʵ����ʵ�����ƫС�����ʵ���Ũ��ƫ�ͣ�
��ת����Һʱ������������������ƿ���棬���ʵ����ʵ�����ƫС�����ʵ���Ũ��ƫ�ͣ�
������ƿ�����������������ˮ�������ʵ����ʵ������䣬��Һ��������䣬���ʵ���Ũ�Ȳ��䣬����Ӱ�죻
�ܶ���ʱ���ӿ̶��ߣ���Һ���ƫС�����ʵ���Ũ��ƫ�ߣ�
��δ��ȴ�����¾ͽ���Һת�Ƶ�����ƿ�����ݣ���ȴ��Һ���½�����Һ���ƫС�����ʵ���Ũ��ƫ�ߣ�
���ݺ�����ƿ������ҡ�ȣ����ú�Һ����ڿ̶��ߣ��ټ�ˮ���̶��ߣ���Һ���ƫ�ߣ����ʵ���Ũ��ƫ�͡�
��Ũ��ƫ�ߵ��ǣ��ܢݣ���Ӱ����ǣ��ۡ�

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ��Ϊȷ��ijNH4NO3��(NH4)2SO4��������ɣ���ȡ4����Ʒ�ֱ����50.0mL��ͬŨ�ȵ�NaOH��Һ�У����ȳ�ַ�Ӧ(���Ⱥ���ȫ���ݳ�)������Ļ����������Ͳ������������(��״��)�Ĺ�ϵ���±���
ʵ����� | �� | �� | �� | �� |
NaOH��Һ���(mL) | 50.0 | 50.0 | 50.0 | 50.0 |
��Ʒ����(g) | 3.44 | m | 17.2 | 21.5 |
NH3���(L) | 1.12 | 2.24 | 5.60 | 5.60 |
�Լ��㣺
(1)m��________g��c(NaOH)��___________ mol��L��1
(2)��Ʒ��NH4NO3��(NH4)2SO4���ʵ���֮��Ϊ______________��
����Ŀ�����в�����Ӧ����������ʵ����
|
|
|
|
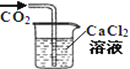
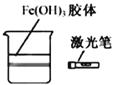
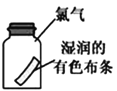
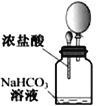
A����������̼����ͨ��CaCl2��Һ�����������ɫ���� | B���ü��������Fe(OH)3���壬�����������ЧӦ�� | C����ʪ�����ɫ��������ʢ�и���������ƿ�У���������ɫ | D�����ι��е�Ũ�������̼��������Һ�����������С��� |
A. A B. B C. C D. D