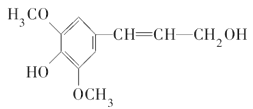
题目内容
【题目】下面有关Na2CO3与NaHCO3的性质比较中错误的是( )
A.相同浓度溶液的碱性:Na2CO3>NaHCO3
B.在水中的溶解度:Na2CO3>NaHCO3
C.与同浓度的硫酸反应放出气泡的速率:NaHCO3<Na2CO3
D.热稳定性:NaHCO3<Na2CO3
【答案】C
【解析】
试题分析:A、相同浓度溶液的碱性Na2CO3>NaHCO3,A正确;B、在水中的溶解度:Na2CO3>NaHCO3,B正确;C、与同浓度的硫酸反应放出气泡的速率:NaHCO3>Na2CO3,C错误;D、热稳定性:NaHCO3<Na2CO3,D正确。答案选C。

【题目】实验室以蛇纹石酸浸出液(主要含Fe3+,还有一定量的Al3+、Mn2+、Ca2+、Mg2+等)为原料制备高纯氧化铁,流程如下:

已知流程中相关金属离子生成氢氧化物沉淀的pH如下表:
氢氧化物 | Fe3+ | Fe2+ | Al3+ |
开始沉淀的pH | 1.1 | 5.8 | 3.0 |
沉淀完全的pH | 3.2 | 8.8 | 5.0 |
(1)“还原”时,应选择_____________(填字母)。
A.Zn粉 B.NaClO溶液 C.Fe粉
(2)“滤渣”的主要成分除含有少量MnF2外,还含有_____________(填化学式)。
(3)“沉锰”时,已知:Ksp(MnS)=4.65×10–14。为确保沉锰完全[即溶液中c(Mn2+)<1.0×10–6 mol·L1],应保持溶液中c(S2-)>_____________mol·L-1。
(4)“除铝”时,控制溶液pH的范围为_____________。
(5)“氧化”时,常用酸性K2Cr2O7溶液检测是否残留未被氧化的金属离子,该反应的离子方程式为_____________。
(6)“沉铁”时,反应温度为85℃条件下,反应时间和反应终点pH对铁的沉淀率的影响分别如下图所示,则最佳的工艺条件是_____________。