题目内容
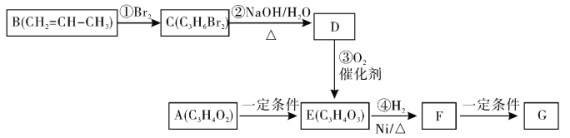
【题目】(1)下列各组化合物中,化学键类型和化合物类型均相同的是_________(填序号)。
①CaCl2和 Na2S ②Na2O 和 Na2O2 ③CO2和CaO ④HCl 和 NaOH
(2)下列过程不一定释放能量的是________。
①化合反应;②分解反应;③形成化学键;④燃料燃烧;⑤酸碱中和;⑥炸药爆炸
(3)Ba(OH)2 8H2O和NH4Cl反应的化学方程式是________________________________,反应过程能量变化的图像符合_____________(填“图1”或“图2”)。

图1 图2
(4)已知1 mol石墨转化为1 mol金刚石要吸收能量,则石墨比金刚石_______(填“稳定”或“不稳定”)。
(5)一定量的氢气在氧气中充分燃烧并放出热量。若生成气态水放出的热量为Q1,生成液态水放出的热量为Q2,那么Q1______Q2(填大于、小于或等于)。
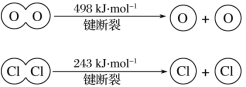
(6)已知:4HCl+O2=2Cl2+2H2O。该反应中,4 mol HCl被氧化,放出115.6 kJ的热量,且断开O=O键和Cl-Cl键所需的能量如下图所示。则断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为______ kJ。
【答案】① ①② Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O 图2 稳定 小于 31.9
【解析】
(1)一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,第IA、第IIA族和第VIA、第VIIA族元素之间易形成离子键;
(2)根据吸热反应和放热反应的类别判断;
(3)Ba(OH)28H2O和NH4Cl反应生成氯化钡,氨气和水,属于吸热反应,判断合适的能量图;
(4)根据自身能量越低越稳定判断;
(5)根据气态水变成液态水放热判断;
(6)根据焓变等于断裂旧的化学键吸收的能量减去形成化学键释放的能量计算。
(1)①CaCl2和Na2S都属于离子化合物,都含有离子键,故①符合题意;
②Na2O和Na2O2都属于离子化合物,Na2O中存在离子键,Na2O2中含有离子键和非极性共价键,故②不符合题意;
③CO2属于共价化合物,主要含有共价键,CaO属于离子化合物,含有离子键;
④HCl属于共价化合物,主要含有共价键,NaOH属于离子化合物,含有离子键和极性共价键;
所以化学键类型和化合物类型均相同的是①;
(2)①绝大多数化合反应释放能量,少数化合反应吸收热量,例如碳和二氧化碳反应生成一氧化碳,故①符合题意;
②绝大多数分解反应吸收能量,少数化合反应释放能量,例如过氧化氢分解制氧气,故②符合题意;
③形成化学键一定释放能量,故③不符合题意;
④燃料燃烧一定释放能量,故④不符合题意;
⑤酸碱中和反应一定释放能量,故⑤不符合题意;
⑥炸药爆炸一定释放能量,故⑥不符合题意;
符合题意的是①②;
(3)Ba(OH)28H2O和NH4Cl反应的化学方程式是Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O,反应为吸热反应,即生成物的能量高于反应物的能量,能量图选择图2;
(4)已知1 mol石墨转化为1 mol金刚石要吸收能量,则石墨比金刚石能量低,能量越低的物质越稳定,石墨比金刚石稳定;
(5)一定量的氢气在氧气中充分燃烧生成气态水放出的热量为Q1,生成液态水放出的热量为Q2,由于气态水转化为液态水还要放热,故生成液态水释放的能量多,Q1小于Q2;
(6)根据化学反应:4HCl+O2=2Cl2+2H2O,放出115.6 kJ的热量,断开1molO=O键和1molCl-Cl键所需的能量分别为498kJ/mol和243kJ/mol,设断开1molH—O键需要的能量为x,断开1 mol H—Cl键所需能量为y,根据反应物断裂吸收的总能量与形成生成物释放的能量差等于反应放出的能量,4y+498kJ/mol-(243kJ/mol×2+4x)=-115.6 kJ,解得x-y=31.9kJ/mol,断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为31.9kJ。

 通城学典默写能手系列答案
通城学典默写能手系列答案