题目内容
将 4 molA气体和 2 molB气体在 2 L 固定体积的容器中混合并在一定条件下发生如下反应:2A(g)+B(g) 2C(g)。若经2 s后测得C的浓度为 0.6 mol·L-1 ,现有下列几种说法,其中正确的是( )
2C(g)。若经2 s后测得C的浓度为 0.6 mol·L-1 ,现有下列几种说法,其中正确的是( )
| A.用物质A表示的反应的平均速率为0.3 mol·L-1·s-1 |
| B.用物质B表示的反应的平均速率为0.6 mol·L-1·s-1 |
| C.2 s时物质A的转化率为70% |
| D.2 s时物质B的浓度为 0.7 mol·L-1 |
AD
解析试题分析:依题意可得各组分的三行数据,则:
2A(g)+B(g) 2C(g)
2C(g)
各组分的起始浓度/ mol?L-1 2 1 0
各组分的变化浓度/ mol?L-1 0.6 0.3 0.6
各组分2 s后浓度/ mol?L-1 1.4 0.7 0.6
则v(A)=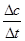 =
=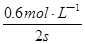 = 0.3 mol·L-1·s-1,故A正确;
= 0.3 mol·L-1·s-1,故A正确;
v(B)=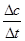 =
= = 0.15 mol·L-1·s-1,故B错;
= 0.15 mol·L-1·s-1,故B错;
2 s时物质A的转化率为 ×100%=
×100%=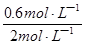 ×100%=30%,故C错;
×100%=30%,故C错;
2 s时物质B的浓度为 0.7 mol·L-1,故D正确。
考点:考查化学反应速率的有关计算,涉及物质的量、容器容积、物质的量的浓度、物质的量在化学方程式中的应用、平均反应速率的计算、反应物的转化率、各组分的变化浓度、一定反应时间后的浓度等等。

 阅读快车系列答案
阅读快车系列答案某温度下,把3molA和2.5molB混合,盛入容积为2L的容器内,使它们发生反应:
3A(气)+B(气) xC(气)+2D(气)
xC(气)+2D(气)
经过5min后达到平衡生成1mol D , 测得C的平均生成速率为0.10mol·L-1·min-1。下列叙述不正确的是
| A.x的值为2 |
| B.B的转化率为20% |
| C.平衡常数为1/3 |
| D.A的平均消耗速率为0.15mol·L-1·min-1 |
如图所示,隔板I固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:A(g) + 2B(g) xC(g)ΔH=-192kJ·mol-1,向M、N中都通入1molA和2molB的混合气体,初始M、N容积相同,保持温度不变。下列说法正确的是 ( )
xC(g)ΔH=-192kJ·mol-1,向M、N中都通入1molA和2molB的混合气体,初始M、N容积相同,保持温度不变。下列说法正确的是 ( )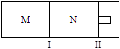
| A.若x=3,达到平衡后A的体积分数关系为:φ(M)>φ(N) |
| B.若x>3,达到平衡后B的转化率关系为:α(M)>α(N) |
| C.若x<3,C的平衡浓度关系为:c(M)>c(N) |
| D.x不论为何值,起始时向N容器中充入任意值的C,平衡后N容器中A的浓度均相等 |
PCl3和PCl5都是重要的化工原料。将PCl3(g)和Cl2(g)充入体积不变的2 L密闭容器中,在一定条件下发生反应,在10 min时达到平衡:PCl3(g)+Cl2(g) PCl5(g)。有关数据如下:
PCl5(g)。有关数据如下:
| | PCl3(g) | Cl2(g) | PCl5(g) |
| 初始浓度/(mol/L) | 2.0 | 1.0 | 0 |
| 平衡浓度/(mol/L) | c1 | c2 | 0.4 |
下列判断错误的是
A.10 min内,v(Cl2)=0.04 mol/(L·min)
B.当反应达到平衡时,容器中Cl2为1.2 mol
C.若升高温度反应的平衡常数减小,则平衡时PCl3的转化率变大
D.平衡后再加入2.0 mol PCl3,在相同条件下再达平衡时,c(PCl5)<1.0mol/L
下列有关化学反应速率和限度的说法中,不正确的是( )
| A.实验室用H2O2分解制O2,加入MnO2后,反应速率明显加快 |
| B.在金属钠与足量水反应中,增加水的量能加快反应速率 |
C.2SO2+O2 2SO3,反应中,SO2不能全部转化为SO3 2SO3,反应中,SO2不能全部转化为SO3 |
| D.实验室用碳酸钙和盐酸反应抽取CO2,用碳酸钙粉末比块状碳酸钙反应要快 |
在一恒温体积可变的密闭容器中发生如下反应:A(g)+B(g) 2C(g) △H<0。t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如图。下列说法正确的是
2C(g) △H<0。t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如图。下列说法正确的是
| A.0~t2时,v正>v逆 |
| B.t2时刻改变的条件可能是加催化剂 |
| C.Ⅰ、Ⅱ两过程达到反应限度时,A的体积分数Ⅰ=Ⅱ |
| D.Ⅰ、Ⅱ两过程达到反应限度时,平衡常数I<Ⅱ |

 N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动