题目内容
【题目】化合物X(仅含三种短周期元素)是一种络合氢化物的储氢材料,在400℃下分解,放出氢气。X中某种元素的单质常用来制造信号弹和烟火,某研究小组为了探究A的组成和性质,设计并完成了如下实验。(金属互化物--全部由金属元素组成的化合物)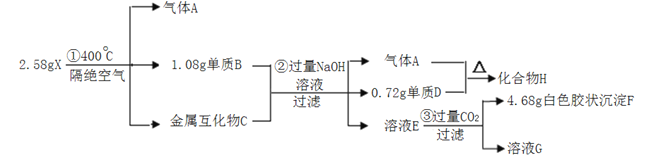
(1)写出单质D对应的阳离子结构示意图:_____。
(2)X在400℃下分解的化学方程式:_____。
(3)写出单质B与NaOH溶液反应的离子方程式:____。
(4)化合物H___(填“可能”或“不可能”)与水发生反应产生H2,判断理由_____。
【答案】![]() 3Mg(AlH4)2=12H2+4Al+Mg3Al2 2H2O+2Al+2OH-=2AlO2- +3H2 可能 MgH2中H元素为-1价,H2O中H元素为+1价,发生氧化还原反应(归中反应)生成H2
3Mg(AlH4)2=12H2+4Al+Mg3Al2 2H2O+2Al+2OH-=2AlO2- +3H2 可能 MgH2中H元素为-1价,H2O中H元素为+1价,发生氧化还原反应(归中反应)生成H2
【解析】
化合物(仅含三种短期元素)是一种络合氢化物的储氢材料,在400℃下分解,放出氢气,则A为H2,X中某种元素的单质常用来制造信号弹和烟火,含有Mg元素,溶液E通入二氧化碳生成白色胶状沉淀,则F应为Al(OH)3,可知X含有Mg、Al、H三种元素,由转化关系可知D为Mg,H为MgH2,B为Al,由题中数据可知n(Mg)=0.72g/24g·mol-1=0.03mol,n(Al)=1.08g/27g·mol-1=0.04mol,n(Al(OH)3)=4.68g/78g·mol-1=0.06mol,X中含有Al的物质的量为0.06mol,C为Mg3Al2,则n(H)=(2.58g-0.03mol×24g·mol-1-0.06mol×27g·mol-1)/1g·mol-1=0.24mol,则X的化学式为Mg(AlH4)2。
(1)D为Mg,单质D对应的阳离子结构示意图:![]() 。
。
(2)X在400℃下分解的化学方程式:3Mg(AlH4)2=12H2+4Al+Mg3Al2。
(3)B为Al,单质B与NaOH溶液反应生成偏铝酸钠和氢气,离子方程式:2H2O+2Al+2OH-=2AlO2- +3H2。
(4)化合物H可能与水发生反应产生H2,判断理由:MgH2中H元素为-1价,H2O中H元素为+1价,发生氧化还原反应(归中反应)生成H2,则可反应。

 阅读快车系列答案
阅读快车系列答案