题目内容
【题目】为使人们确知含碘物质的存在,研究性学习小组同学设计了一种简便的检验方法,利用该物质在酸性条件下与KI反应有单质碘生成的性质,选用下列生活常见的物质就可完成.请你从下列物质中选出合适的一组( ) ①自来水 ②食醋 ③淀粉 ④食糖 ⑤碘化钾试纸 ⑥碘酒.
A.①③④⑤
B.②③④⑤
C.①③⑤⑥
D.①②③⑤
【答案】D
【解析】解:食醋能提供酸性环境,碘化钾溶液能提供碘离子,碘与淀粉变蓝色,所以淀粉能提供反应物,故选D.

【题目】2017年春节,京津冀及周边区域遭遇“跨年”雾霾,二氧化硫、氮氧化物以及可吸入颗粒物这三项是雾霾主要组成,消除氮氧化物污染是研究方向之一。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574.0 kJ·mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160.0 kJ·mol-1
③H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1
请写出CH4(g)与NO2(g)反应生成N2(g) ,CO2(g)和H2O(l)的热化学方程式_______________________ 。
(2)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g)![]() N2(g)+CO2(g),某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T0C)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g),某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T0C)条件下反应,反应进行到不同时间测得各物质的浓度如下:
浓度(mol/L) 时间(min) | NO | N2 | CO2 |
0 | 0.100 | 0 | 0 |
10 | 0.058 | 0.021 | 0.021 |
20 | 0.040 | 0.030 | 0.030 |
30 | 0.040 | 0.030 | 0.030 |
40 | 0.032 | 0.034 | 0.017 |
50 | 0.032 | 0.034 | 0.017 |
①下列说法不能作为判断该反应达到化学平衡状态标志的是_______
A.活性炭的质量 B.v 正(N2) = 2v逆 (NO)
C.容器内压强保持不变 D.容器内混合气体的密度保持不变
E.容器内混合气体的平均相对分子质量保持不变
F.容器内CO2的浓度保持不变
②在T0C时,该反应的平衡常数为______________(小数点后保留两位有效数字);
③在30 min时,若只改变某一条件,反应重新达到平衡,则改变的条件是___________;
④在50 min时保持温度和容器体积不变再充入NO和N2,使二者的浓度均增加至原来的两倍,则化学平衡_______(填“正向移动”、“逆向移动”或“不移动”)
(3)利用反应6NO2+8NH3= 7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示。

①A电极的电极反应式为______________
②下列关于该电池的说法正确的是(_____)
A.电子从右侧电极经过负载后流向左侧电极
B.为使电池持续放电,离子交换膜需选用阴离子交换膜
C.电池工作一断时间,溶液的pH不变
D.当有4.48LNO2被处理时,转移电子物质的量为0.8mol
【题目】已知:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O。
某化学小组根据上述反应原理进行下列实验:
Ⅰ.测定H2C2O4溶液的物质的量浓度
实验步骤如下:
①取待测H2C2O4溶液25.00mL放入锥形瓶中,再加入适量的稀硫酸;
②用0.1mol·L-1KMnO4溶液滴定至终点,记录数据;
③重复滴定2次,平均消耗KMnO4溶液20.00mL。
请回答:
(1)滴定时,将KMnO4溶液装在________(填“酸式”或“碱式”)滴定管中。
(2)若在步骤①操作之前,先用待测H2C2O4溶液润洗锥形瓶,则测得H2C2O4溶液的浓度会________(填“偏大”“偏小”或“无影响”)。
(3)步骤②中到达滴定终点时的现象为________。
(4)计算H2C2O4溶液的物质的量浓度为________mol·L-1。
Ⅱ.探究反应物浓度对化学反应速率的影响设计如下实验方案(实验温度均为25℃):
实验序号 | 体积V/mL | |||
0.1mol·L-1KMnO4溶液 | 0.1mol·L-1H2C2 O4溶液 | 0.1mol·L-1H2SO4溶液 | H2O | |
① | 2.0 | 5.0 | 6.0 | 7.0 |
② | 2.0 | 8.0 | 6.0 | V1 |
③ | 2.0 | V2 | 6.0 | 2.0 |
请回答:
(5)表中V1=________,V2=________。
(6)实验中需要测量的数据是________。
(7)实验中________(填“能”或“不能”)用0.2mol·L-1盐酸代替0.1mol·L-1H2SO4溶液,理由是________。
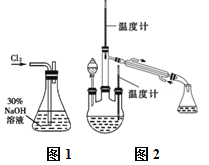
【题目】新制氯水中含有多种粒子,某校化学研究性学习小组的同学为探究其性质,做了如下实验,请你帮助完成:
(1)HClO不稳定,见光易分解生成HCl和O2。请设计实验证明有O2生成_____________________。
(2)氯气能使湿润的红色布条褪色。对于使红色布条褪色的物质,同学们的看法不一致,认为氯水中存在的几种粒子都有可能。请你设计实验,得出正确结论。
提出问题 | 收集资料 | 提出假设 | 验证假设 | 得出结论 |
氯水中何种物质能使湿润的红色布条褪色? | ①氯气有强氧化性 ②氯气与冷水反应生成盐酸和次氯酸 ③次氯酸有强氧化性 | ①________。 ②盐酸使布条褪色 ③________。 ④H2O使布条褪色 | 实验①:把红色干布条放入充满氯气的集气瓶中,布条不褪色; 实验②:_________。 实验③:_______。 实验④:把红色布条放在水里,布条不褪色。 | 结论: ________ |
(3)已知室温下,H2CO3![]() HCO3-+H+Ka1(H2CO3)=4.45×10-7
HCO3-+H+Ka1(H2CO3)=4.45×10-7
HCO3-![]() CO32-+H+Ka2(H2CO3)=5.61×10-11
CO32-+H+Ka2(H2CO3)=5.61×10-11
HClO![]() H++ClO-Ka(HClO)=2.95×10-8
H++ClO-Ka(HClO)=2.95×10-8
HCN![]() H++CN-Ka(HCN)=5×10-10
H++CN-Ka(HCN)=5×10-10
少量CO2通入NaCN溶液中的化学方程式____________________
少量的氯气通入到过量的碳酸钠溶液中的离子方程式____________________;
室温下等浓度的a.NaCN溶液 b.NaClO溶液 c.NaHCO3溶液的pH从大到小的顺序是_________________;
室温下0.05mol/L NaCN溶液的pH为_________________