题目内容
【题目】水合肼(N2H4·H2O)又名水合联氨,无色透明,具有腐蚀性和强还原性的碱性液体,它是一种重要的化工试剂。利用尿素法生产水合肼的原理为:CO(NH2)2+2NaOH+NaC1O=Na2CO3+N2H4·H2O+NaCl
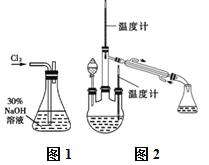
实验一:制备NaClO溶液。(实验装置如图1所示)
(1)配制30%NaOH溶液时,所需玻璃仪器除量筒外还有______(填标号)。
A.玻璃棒 B.烧杯 C.烧瓶 D.容量瓶 E.胶头滴管
(2)锥形瓶中发生反应的离子方程式是___________________。
实验二:制取水合肼。(实验装置如图2所示)
(3)①仪器A的名称为_______________。
②反应过程中需控制反应温度,同时将分液漏斗中溶液缓慢滴入A中,如果滴速过快则会导致产品产率降低,同时产生大量氮气,写出该过程的化学反应方程式:__________,故分液漏斗中的溶液是______(填标号)。
A.CO(NH2)2溶液 B.NaOH和NaClO
③充分反应后,加热蒸馏A内的溶液,收集108~114℃馏分,即可得到水合肼的粗产品。
实验三:测定馏分中肼含量。
(4)称取馏分5.0g,加入适量NaHCO3固体,加水配成250mL溶液,移出25.00mL置于锥形瓶中,并滴加23滴淀粉溶液,用0.10mol·L-1的I2溶液滴定。滴定过程中,溶液的pH保持在6.5左右。(已知:N2H4·H2O+2I2=N2↑+4HI+H2O)
①滴定时,碘的标准溶液盛放在______(填"酸式”或“碱式”)滴定管中,本实验滴定终点的现象为____________________。
②实验测得消耗I2溶液的平均值为18.00mL,馏分中水合肼(N2H4·H2O)的质重分数为__________。
【答案】 ABE Cl2+2OH-=ClO-+ Cl-+H2O 三颈烧瓶 N2H4·H2O + 2NaClO = N2↑ + 3H2O + 2NaCl
或CO(NH2)2+2NaOH+3NaClO = Na2CO3+N2 ↑ +3NaCl + 3H2O B 酸式 溶液出现蓝色且半分钟内不消失 9%
【解析】(1)配制30%NaOH溶液时,用天平称量质量,在烧杯中加水溶解,并用玻璃棒搅拌,需要玻璃仪器有:烧杯、玻璃棒,胶头滴管等,故答案为:ABE;
(2)锥形瓶中氯气与氢氧化钠反应生成氯化钠、次氯酸钠与水,反应离子方程式为:Cl2+2OH-=ClO-+Cl-+H2O,故答案为:Cl2+2OH-=ClO-+Cl-+H2O;
(3)根据图示可知,仪器A为三颈烧瓶;N2H4H2O具有强还原性,容易被过量的NaClO氧化,会发生反应:N2H4H2O+2NaClO=N2↑+3H2O+2NaCl,应将NaOH和NaClO混合溶液滴入CO(NH2)2溶液中,故分液漏斗中盛放的为NaOH和NaClO混合溶液,故答案为:三颈烧瓶;N2H4H2O+2NaClO=N2↑+3H2O+2NaCl;B;
(4)①碘的标准溶液具有氧化性,可以腐蚀橡皮管,应盛放在酸式滴定管中;肼反应完全,再滴入碘的标准溶液后,遇淀粉变蓝色,实验滴定终点的现象为:溶液出现蓝色且半分钟内不消失,故答案为:酸式;溶液出现蓝色且半分钟内不消失;
②设馏分中水合肼(N2H4H2O)的质量分数为a,则:
N2H4H2O + 2I2=N2↑+4HI+H2O
50g 2mol
5g×a 0.018L×0.1mol/L×![]()
所以50g:5g×a=2mol:0.018L×0.1mol/L×![]() ,解得:a=9%,故答案为:9%。
,解得:a=9%,故答案为:9%。

 名校课堂系列答案
名校课堂系列答案