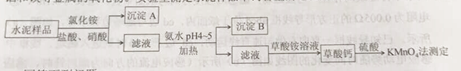
题目内容
【题目】[化学——选修3:物质结构与性质](15分)
我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R代表)。回答下列问题:
(1)氮原子价层电子对的轨道表达式(电子排布图)为。
(2)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的E1变化趋势如图(a)所示,其中除氮元素外,其他元素的E1自左而右依次增大的原因是;氮元素的E1呈现异常的原因是。
(3)经X射线衍射测得化合物R的晶体结构,其局部结构如图(b)所示。
①从结构角度分析,R中两种阳离子的相同之处为 , 不同之处为。(填标号)
A.中心原子的杂化轨道类型 B.中心原子的价层电子对数
C.立体结构 D.共价键类型
②R中阴离子N5-中的σ键总数为个。分子中的大π键可用符号 ![]() 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为 ![]() ),则N5-中的大π键应表示为。
),则N5-中的大π键应表示为。
③图(b)中虚线代表氢键,其表示式为(NH4+)N-H┄Cl、、。
(4)R的晶体密度为dg·cm-3 , 其立方晶胞参数为anm,晶胞中含有y个[(N5)6(H3O)3(NH4)4Cl]单元,该单元的相对质量为M , 则y的计算表达式为。
【答案】
(1)
(2)从左到右非金属性增强,失电子能力减弱;N的p能级处于半充满状态
(3)AD;BC;5 ![]() ;
;![]() ;(H3O+) O—H…N;(NH4+)N—H…N
;(H3O+) O—H…N;(NH4+)N—H…N
(4)![]()
【解析】(1)N原子最外层电子排布式为2s22p3 , 根据能量最低原理,泡利不相容原理,洪特规则得N的价层电子排布图为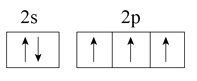
(2)同周期元素,从左到右非金属性依次增大,原子核对电子的束缚能力增大,除氮原子外,其他原子得电子能力依次增大,得电子后形成的阴离子稳定性逐渐增大,因此电子亲和能增大;N的3p轨道上有3个电子,处于半满状态,较稳定,得电子能力相对较弱,因此电子亲和能减小.
(3)NH4+和H3O+均为sp3杂化,价层电子对数为4,且所有的共价键都是极性键,故相同之处为ABD. H3O+中有3个共价键和1对孤对电子,空间构型为三角锥;NH4+中有4个共价键,呈正四面体.②由N5-的结构图,得σ键总数为5个.
每个N原子有且只有一个p轨道与N5-环平面垂直,一个p轨道中有1个电子,外来的1个电子也进入这种p轨道中,因此π电子总数为1×5+1=6(个).∴大π键表示为![]() .
.
③由图得,NH4+和H3O+中的H与N5-、Cl-都可形成氢键,可得以上答案.
(4)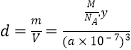 =
=![]() ,则y=
,则y=![]()

【题目】(13分)TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下: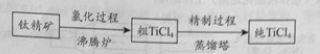
资料:TiCl4及所含杂质氯化物的性质
化合物 | SiCl4 | TiCl4 | AlCl3 | FeCl3 | MgCl2 |
沸点/℃ | 58 | 136 | 181(升华) | 316 | 1412 |
熔点/℃ | -69 | -25 | 193 | 304 | 714 |
在TiCl4中的溶解性 | 互溶 | —— | 微溶 | 难溶 | |
(1)氯化过程:TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行。
已知:TiO2(s)+2 Cl2(g)= TiCl4(g)+ O2(g) ΔH1=+175.4 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH2=-220.9 kJ·mol-1
①沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式:。
②氯化过程中CO和CO2可以相互转化,根据如图判断:CO2生成CO反应的ΔH0(填“>”“<”或“=”),判断依据:。
③氯化反应的尾气须处理后排放,尾气中的HCl和Cl2经吸收可得粗盐酸、FeCl3溶液,则尾气的吸收液依次是。
④氯化产物冷却至室温,经过滤得到粗TiCl4混合液,则滤渣中含有。
(2)精制过程:粗TiCl4经两步蒸馏得纯TiCl4。示意图如下:
物质a是 , T2应控制在。