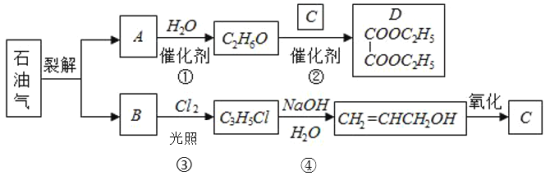
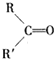
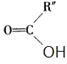
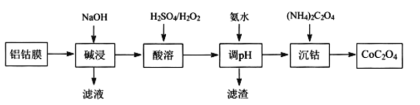
题目内容
【题目】将a g二氧化锰粉末加入b mol/L的浓盐酸c L中加热完全溶解,反应中转移电子d个,设NA为阿伏加德罗常数的值,下列叙述正确的是
A.可以收集到氯气![]() B.反应后溶液中的Cl-数目为:
B.反应后溶液中的Cl-数目为:![]()
C.NA可表示为:![]() D.反应后溶液中的H+数目为:bc-2d
D.反应后溶液中的H+数目为:bc-2d
【答案】C
【解析】
反应方程式为MnO2+4HCl![]() MnCl2+Cl2↑+2H2O,固体全部溶解说明MnO2完全反应,盐酸过量;根据方程式可知转移1mol电子,生成0.5molCl2,消耗1molCl-。
MnCl2+Cl2↑+2H2O,固体全部溶解说明MnO2完全反应,盐酸过量;根据方程式可知转移1mol电子,生成0.5molCl2,消耗1molCl-。
A.温度和压强不知,氯气体积不能计算,A错误;
B.反应后溶液中的Cl-数目为(bcNA-d)个,选项中只是计算生成的氯化锰中的氯离子,忽略了盐酸过量还有氯离子剩余,B错误;
C.依据电子转移守恒,MnO2~MnCl2~2e-,![]() ×2×NA=d,得到NA=
×2×NA=d,得到NA=![]() ,C正确;
,C正确;
D.由于浓盐酸易挥发,无法计算反应后溶液中H+的数目,D错误;
答案选C。

练习册系列答案
相关题目
【题目】今有氧、镁、铝、硫、铬5种元素,试回答下列问题
(1)镁晶体堆积方式为___堆积(选填:“简单立方”、“体心立方”、“面心立方”、“六方”);
(2)用“>”、“<”填写下表
第一电离能 | 电负性 | 晶格能 | 沸点 |
Mg___Al | O___S | MgO___MgS | H2O___H2S |
(3)基态铬原子外围电子轨道表示式为___。