题目内容
【题目】甲、乙、丙、丁分别是Na2CO3溶液、AgNO3溶液、BaCl2溶液、盐酸四种无色溶液中的一种,现进行了如图1所示的实验。
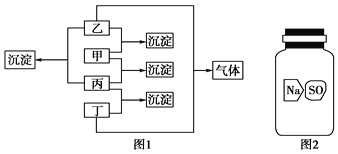
(1)通过上述实验判断出各物质:甲________、乙________、丙________、丁________。写出甲与乙反应的离子方程式______________________。
(2)实验室有一瓶标签破损(如图2所示)的固体试剂。某同学应用(1)中的BaCl2溶液检验,取试剂瓶中的固体少量于试管中,加适量蒸馏水溶解,在所得溶液中加入过量BaCl2溶液,得到白色沉淀。由此,该同学推断这瓶试剂是硫酸钠。你认为他的结论是否正确?________。若正确,请写出相应的离子反应方程式;若不正确,请说明可能的结论,并给出进一步验证的实验方案(要求:所用试剂只能从甲、乙、丙、丁中选用):__________________________________________________。
【答案】BaCl2溶液 Na2CO3溶液AgNO3溶液盐酸Na2CO3+BaCl2![]() BaCO3↓+2NaCl不正确将沉淀完全的溶液静置,取上层清液于另一试管中,滴加Na2CO3溶液,如有气体产生,说明固体物质是NaHSO4;若无明显现象,则向除去上层清液的试管中滴加盐酸,若滴加时有气体产生,最终沉淀溶解,则固体物质是Na2SO3;若滴加过程中无明显现象,则固体物质是Na2SO4
BaCO3↓+2NaCl不正确将沉淀完全的溶液静置,取上层清液于另一试管中,滴加Na2CO3溶液,如有气体产生,说明固体物质是NaHSO4;若无明显现象,则向除去上层清液的试管中滴加盐酸,若滴加时有气体产生,最终沉淀溶解,则固体物质是Na2SO3;若滴加过程中无明显现象,则固体物质是Na2SO4
【解析】
(1)盐酸只能和AgNO3生成沉淀,故丁为盐酸,丙为硝酸银;丁和乙生成气体,乙为碳酸钠;剩余的甲就是氯化钡;甲就是氯化钡,乙为碳酸钠,两者反应生成难溶的碳酸钡和氯化钠,离子方程式为:Na2CO3+BaCl2BaCO3↓+2NaCl。
(2)氯化钡与硫酸钡反应可以生成硫酸钡沉淀,但氯化钡和硫酸氢钠生成硫酸钡沉淀,NaHSO4+BaCl2=BaSO4+NaCl+HCl不能断定试剂就为硫酸钠;将沉淀完全的溶液静置,取上层清液于另一试管中,滴加Na2CO3溶液,如有气体产生,说明固体物质是NaHSO4;若无明显现象,则向除去上层清液的试管中滴加盐酸,若滴加时有气体产生,最终沉淀溶解,则固体物质是Na2SO3;若滴加过程中无明显现象,则固体物质是Na2SO4。

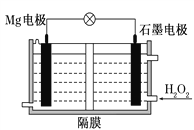
【题目】一种从含Br-废水中提取Br2的过程,包括过滤、氧化、正十二烷萃取及蒸馏等步骤。已知:
Br2 | CCl4 | 正十二烷 | |
密度/g·cm-3 | 3.119 | 1.595 | 0.753 |
沸点/℃ | 58.76 | 76.8 | 215~217 |
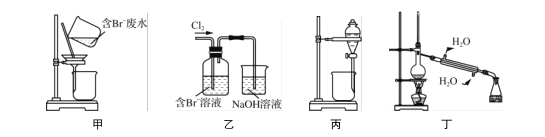
下列说法正确的是( )
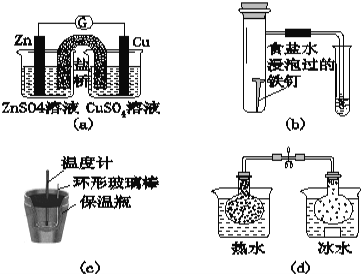
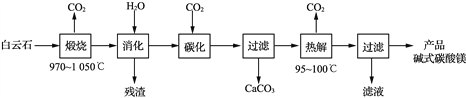
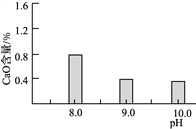
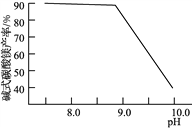
A. 用甲装置过滤时,需不断搅拌
B. 用乙装置将Br-氧化为Br2
C. 丙装置中用正十二烷而不用CCl4,是因为其密度小
D. 可用装置丁进行蒸馏,先收集正十二烷再收集Br2