题目内容
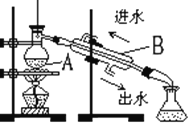
【题目】给下图中①~⑤选择适当的物质,使有连线的两物质能发生反应。供选择的试剂有稀硫酸、二氧化碳、铜片、食盐、生石灰、一氧化碳、纯碱、铁片和木炭粉。

(1)请推断它们的化学式分别为:②_______;③_______;⑤______。
(2)写出下列序号之间的化学方程式:
①和②:________;②和④:________;③和④:___________。
【答案】H2SO4CO2Na2CO3Fe+H2SO4=FeSO4+H2↑CaO+H2SO4=CaSO4+H2OCO2+CaO=CaCO3
【解析】
(1)在题目提供的物质中,单质①与酸②反应,则①为Fe、②为H2SO4,酸能与盐⑤反应,则⑤为Na2CO3,氧化物④能与⑤反应,则④为CaO,氧化物③能与氧化物④反应,则③为CO2,综上所述,②为H2SO4;③为CO2;⑤为Na2CO3;本题答案是:H2SO4,CO2,Na2CO3。
(2)据以上分析可知:①和②反应的化学方程式为:Fe+H2SO4=FeSO4+H2↑;据以上分析可知:②和④反应的化学方程式为:CaO+H2SO4=CaSO4+H2O;据以上分析可知:③和④反应的化学方程式为:CO2+CaO=CaCO3。综上所述,答案是:Fe+H2SO4=FeSO4+H2↑,CaO+H2SO4=CaSO4+H2O,CO2+CaO=CaCO3。

【题目】已知:2CH3OH(g)![]() CH3OCH3(g)+H2O(g) ΔH=-25 kJ·mol-1。某温度下的平衡常数为400。此温度下,在1 L体积不变的密闭容器中加入CH3OH,某时刻测得各组分的物质的量浓度如下表。下列说法中不正确的是( )
CH3OCH3(g)+H2O(g) ΔH=-25 kJ·mol-1。某温度下的平衡常数为400。此温度下,在1 L体积不变的密闭容器中加入CH3OH,某时刻测得各组分的物质的量浓度如下表。下列说法中不正确的是( )
物质 | CH3OH | CH3OCH3 | H2O |
c/mol·L-1 | 0.08 | 1.6 | 1.6 |
A. 此时刻反应达到平衡状态
B. 容器内压强不变时,说明反应达平衡状态
C. 平衡时,再加入与起始等量的CH3OH,达新平衡后CH3OH转化率不变
D. 平衡时,反应混合物的总能量降低40 kJ
【题目】a、b、c、d、e均为周期表前四周期元素,原子序数依次增大,相关信息如下表所示。
a | 原子核外电子分占3个不同能级,且每个能级上排布的电子数相同 |
b | 基态原子的p轨道电子数比s轨道电子数少1 |
c | 位于第2周期,原子核外有3对成对电子、两个未成对电子 |
d | 位于周期表中第7纵列 |
e | 基态原子M层全充满,N层只有一个电子 |
请回答:
(1)c属于_____________区的元素,其基态原子的电子排布图为________________________。
(2)b与其同周期相邻元素第一电离能由大到小的顺序为______________(用元素符号表示)。
(3)元素b 的氢化物的水溶液中存在的氢键有_______种;画出一种存在于b 的氢化物与水分子之间的氢键________________________________。
(4)a与其同主族短周期元素的最高价氧化物的熔点高低顺序为___________(用化学式表示)。若将a元素最高价氧化物水化物对应的正盐酸根离子表示为A,则A的中心原子的轨道杂化类型为_____________,A的空间构型为____________________;
(5)a元素与b元素可形成ab-阴离子,则与ab-互为等电了体的单质及化合物的化学式分别为_____________、______________(各填写一种)。
(6)在e2+离子的水溶液中逐滴滴加b的氢化物水溶液至过量,可观察到的现象为________________。
(7)d 的某氧化物晶体结构如图。每个阴离子周围等距离且最远的阴离子数为_______________,其晶胞的棱长为xcm,则该晶体距离最近的两个阴离了的核间距为_________cm (用含有x 的代数式表示)。