题目内容
【题目】a、b、c、d、e均为周期表前四周期元素,原子序数依次增大,相关信息如下表所示。
a | 原子核外电子分占3个不同能级,且每个能级上排布的电子数相同 |
b | 基态原子的p轨道电子数比s轨道电子数少1 |
c | 位于第2周期,原子核外有3对成对电子、两个未成对电子 |
d | 位于周期表中第7纵列 |
e | 基态原子M层全充满,N层只有一个电子 |
请回答:
(1)c属于_____________区的元素,其基态原子的电子排布图为________________________。
(2)b与其同周期相邻元素第一电离能由大到小的顺序为______________(用元素符号表示)。
(3)元素b 的氢化物的水溶液中存在的氢键有_______种;画出一种存在于b 的氢化物与水分子之间的氢键________________________________。
(4)a与其同主族短周期元素的最高价氧化物的熔点高低顺序为___________(用化学式表示)。若将a元素最高价氧化物水化物对应的正盐酸根离子表示为A,则A的中心原子的轨道杂化类型为_____________,A的空间构型为____________________;
(5)a元素与b元素可形成ab-阴离子,则与ab-互为等电了体的单质及化合物的化学式分别为_____________、______________(各填写一种)。
(6)在e2+离子的水溶液中逐滴滴加b的氢化物水溶液至过量,可观察到的现象为________________。
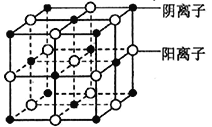
(7)d 的某氧化物晶体结构如图。每个阴离子周围等距离且最远的阴离子数为_______________,其晶胞的棱长为xcm,则该晶体距离最近的两个阴离了的核间距为_________cm (用含有x 的代数式表示)。
【答案】 p ![]() N>O>C 4 N—H…O或O—H…N SiO2>CO2 sp2 平面三角形 N2 CO 先产生蓝色沉淀,氨水过量后沉淀溶解,生成深蓝色溶液 12
N>O>C 4 N—H…O或O—H…N SiO2>CO2 sp2 平面三角形 N2 CO 先产生蓝色沉淀,氨水过量后沉淀溶解,生成深蓝色溶液 12 ![]() x
x
【解析】根据题意可推知这几种元素分别是:a是C;b是N;c是O;d是Cl;e是Cu。(1)氧元素属于周期表中p区元素,其基态原子的电子排布图为![]() ;(2)与b为同周期相邻元素为C、O,其第一电离能由大到小的顺序为N>O>C;(3)氨水中存在O-H…N、O-H…O、N-H…N、N-H…O四种氢键;其中N—H…O或O—H…N表示氨与水分子间形成的氢键;(4)a的氧化物为二氧化碳,属于分子晶体,与其同主族短周期元素的最高价氧化物为二氧化硅,属于原子晶体,故其熔点:SiO2>CO2;a元素最高价氧化物水化物对应的正盐酸根离子为CO32—,碳原子采取的sp2杂化,其空间构型为平面三角形;(5)a元素与b元素可形成CN-阴离子,则与CN-互为等电了体的单质及化合物的化学式分别为N2、CO;(6)在Cu2+离子的水溶液中逐滴滴加氨水至过量现象为:先产生蓝色沉淀,氨水过量后沉淀溶解,生成深蓝色溶液;(7)观察晶胞可知,每个阴离子周围等距离且最近的阴离子数为12;晶体距离最近的两个阴离了的核间距为acm,即
;(2)与b为同周期相邻元素为C、O,其第一电离能由大到小的顺序为N>O>C;(3)氨水中存在O-H…N、O-H…O、N-H…N、N-H…O四种氢键;其中N—H…O或O—H…N表示氨与水分子间形成的氢键;(4)a的氧化物为二氧化碳,属于分子晶体,与其同主族短周期元素的最高价氧化物为二氧化硅,属于原子晶体,故其熔点:SiO2>CO2;a元素最高价氧化物水化物对应的正盐酸根离子为CO32—,碳原子采取的sp2杂化,其空间构型为平面三角形;(5)a元素与b元素可形成CN-阴离子,则与CN-互为等电了体的单质及化合物的化学式分别为N2、CO;(6)在Cu2+离子的水溶液中逐滴滴加氨水至过量现象为:先产生蓝色沉淀,氨水过量后沉淀溶解,生成深蓝色溶液;(7)观察晶胞可知,每个阴离子周围等距离且最近的阴离子数为12;晶体距离最近的两个阴离了的核间距为acm,即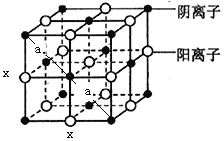 ,根据勾股定律得:x2+ x2=(2a)2,解得a=
,根据勾股定律得:x2+ x2=(2a)2,解得a=![]()
![]() x。
x。




