题目内容
【题目】某硫酸工厂的废水中含有较多的H+、Cu2+、Fe2+、SO42-、AsO43-、HAsO42-、 H2AsO4-等需要处理的杂质离子,其中一种处理流程如图所示

已知:Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)2]=8.6×10-16;H3AsO4为弱酸。
(1)沉淀A的主要成分的化学式是__________________。
(2)常温下pH=7的溶液中Cu2+的物质的量浓度为_______,此时Fe2+是否沉淀完全_______(填“是”或“否”)。
(3)若氧化过程中生成了某种胶体,用离子方程式解释氧化过程中溶液pH降低的原因__________。
(4)最后一次调节pH时pH过低或过高砷的去除率都会明显降低,pH过低时可能的原因是________(从平衡角度解释);pH过高时可能的原因是_________________(从沉淀转化的角度解释)。
(5)硫化法是另一种处理含砷废水的方法,涉及的反应有
Na2S+H2SO4![]() Na2SO4+H2S ①
Na2SO4+H2S ①
2H3AsO3+3H2S![]() As2S3↓+6H2O ②
As2S3↓+6H2O ②
As2S3+H2SO4(浓) ![]() As2O3↓+4S↓+H2O ③
As2O3↓+4S↓+H2O ③
在反应①和③中,硫酸表现出的性质依次是_______、_______。
【答案】 CaSO4 2.2×10-6mol/L 否 4Fe2++O2+10H2O=4Fe(OH)3(胶体)+8H+ H+会抑制H3AsO4的电离,溶液中AsO43-浓度较小,不易与Fe3+形成沉淀 FeAsO4会转化为Fe(OH)3沉淀,AsO43-又进入水中(答案合理即可) 酸性 (强)氧化性
【解析】根据Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)2]=8.6×10-16;可知,铜离子完全沉淀时的c(OH-)=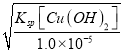 =
=![]() =
=![]() ×10-8,pH约为7;亚铁离子完全沉淀时的c(OH-)=
×10-8,pH约为7;亚铁离子完全沉淀时的c(OH-)=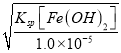 =
=![]() =
=![]() ×10-6,pH在8~9;H3AsO4为弱酸。某硫酸工厂的废水中含有较多的H+、Cu2+、Fe2+、SO42-、AsO43-、HAsO42-、 H2AsO4-等需要处理的杂质离子,在废水中加入石灰乳,并调节pH=3,根据上述计算,只有硫酸钙可能形成沉淀,加入氢氧化钠调节pH=7,能够使铜离子沉淀,通入空气将亚铁离子氧化,生成铁离子,加入氢氧化钠调节pH=5~7,形成FeAsO4。
×10-6,pH在8~9;H3AsO4为弱酸。某硫酸工厂的废水中含有较多的H+、Cu2+、Fe2+、SO42-、AsO43-、HAsO42-、 H2AsO4-等需要处理的杂质离子,在废水中加入石灰乳,并调节pH=3,根据上述计算,只有硫酸钙可能形成沉淀,加入氢氧化钠调节pH=7,能够使铜离子沉淀,通入空气将亚铁离子氧化,生成铁离子,加入氢氧化钠调节pH=5~7,形成FeAsO4。
(1)根据上述分析,沉淀A的主要成分为硫酸钙,故答案为:CaSO4;
(2)常温下pH=7的溶液中Cu2+的物质的量浓度为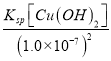 =
=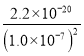 =2.2×10-6 mol/L,此时c(Fe2+)=
=2.2×10-6 mol/L,此时c(Fe2+)=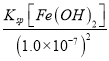 =
=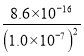 =8.6×10-2 mol/L,Fe2+没有沉淀完全,故答案为:2.2×10-6mol/L;否;
=8.6×10-2 mol/L,Fe2+没有沉淀完全,故答案为:2.2×10-6mol/L;否;
(3)若氧化过程中生成了某种胶体,可能的原因是4Fe2++O2+10H2O=4Fe(OH)3(胶体)+8H+,溶液pH降低,故答案为:4Fe2++O2+10H2O=4Fe(OH)3(胶体)+8H+;
(4)最后一次调节pH时,pH过低或过高砷的去除率都会明显降低,pH过低时,H+会抑制H3AsO4的电离,溶液中AsO43-浓度较小,不易与Fe3+形成沉淀;pH过高时,FeAsO4会转化为Fe(OH)3沉淀,AsO43-又进入水中,故答案为:H+会抑制H3AsO4的电离,溶液中AsO43-浓度较小,不易与Fe3+形成沉淀;FeAsO4会转化为Fe(OH)3沉淀,AsO43-又进入水中;
(5)反应①Na2S+H2SO4![]() Na2SO4+H2S为非氧化还原反应,体现了硫酸的酸性;反应③As2S3+H2SO4(浓)
Na2SO4+H2S为非氧化还原反应,体现了硫酸的酸性;反应③As2S3+H2SO4(浓) ![]() As2O3↓+4S↓+H2O中硫酸中S元素的化合价降低,被含有,体现了硫酸的氧化性,故答案为:酸性;氧化性。
As2O3↓+4S↓+H2O中硫酸中S元素的化合价降低,被含有,体现了硫酸的氧化性,故答案为:酸性;氧化性。

 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案【题目】正丁醚常用作有机反应的溶剂。实验室制备正丁醚的反应和主要实验装置如下:
2CH3CH2CH2CH2OH![]() (CH3CH2CH2CH2)2O + H2O。反应物和产物的相关数据如下
(CH3CH2CH2CH2)2O + H2O。反应物和产物的相关数据如下

相对分子质量 | 沸点/℃ | 密度/(g·cm-3) | 水中溶解性 | |
正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
正丁醚 | 130 | 142.0 | 0.7704 | 几乎不溶 |
合成反应:
①将6 mL浓硫酸和37 g正丁醇,按一定顺序添加到A中,并加几粒沸石。
②加热A中反应液,迅速升温至135℃,维持反应一段时间。
分离提纯:
③待A中液体冷却后将其缓慢倒入盛有70 mL水的分液漏斗中,振荡后静置,分液得粗产物。
④粗产物依次用40 mL水、20 mL NaOH溶液和40 mL水洗涤,分液后加入约3 g无水氯化钙颗粒,静置一段时间后弃去氯化钙。
⑤将上述处理过的粗产物进行蒸馏,收集馏分,得纯净正丁醚11 g。
请回答:
(1)步骤①中浓硫酸和正丁醇的添加顺序为 。
(2)加热A前,需先从 (填“a”或“b”)口向B中通入水。
(3)步骤③的目的是初步洗去 ,振荡后静置,粗产物应从分液漏斗的 (填“上”或“下”)口分离出。
(4)步骤④中最后一次水洗的目的为 。
(5)步骤⑤中,加热蒸馏时应收集 (填选项字母)左右的馏分。
a.100℃ b. 117℃ c. 135℃ d.142℃
(6)反应过程中会观察到分水器中收集到液体物质,且分为上下两层,随着反应的进行,分水器中液体逐渐增多至充满时,上层液体会从左侧支管自动流回A。分水器中上层液体的主要成分为 ,下层液体的主要成分为 。
(7)本实验中,正丁醚的产率为 。(保留两位有效数字)


