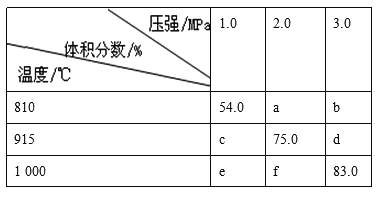
题目内容
【题目】(1)根据下列图示,写出反应的热化学方程式。

A.___________________________________。
B.___________________________________。
(2)已知16 g固体硫完全燃烧时放出148.4 kJ的热量,该反应的热化学方程式为___________________。
(3)如图是598 K时,N2与H2反应过程中能量变化的曲线图。该反应的热化学方程式为_______________________________。

【答案】(1)CO(g)+H2O(g)===CO2(g)+H2(g) ΔH=41 kJ·mol1(2分)
CO2(g)+H2(g)===CO(g)+H2O(g) ΔH=+41 kJ·mol1(2分)
(2)S(s)+O2(g)===SO2(g) ΔH=296.8 kJ·mol1(2分)
(3)N2(g)+3H2(g)![]() 2NH3(g) ΔH=92 kJ·mol1(2分)
2NH3(g) ΔH=92 kJ·mol1(2分)
【解析】(1)根据图象可判断反应物和生成物,以及反应热ΔH。
(2)16 g固体硫物质的量是0.5 mol,则1 mol固体硫燃烧放出296.8 kJ的能量。
(3)根据图象可判断该反应是吸热还是放热,再根据反应物与生成物的能量差,得出反应热,写出热化学方程式。

练习册系列答案
相关题目