题目内容
(中国古代四大发明之一--黑火药,它的爆炸反应为:2KNO3+3C+S
A+N2↑+3CO2↑(已配平)
①除 S 外,上列元素的电负性从大到小依次为
②生成物中,A 的电子式为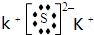
 ,含极性共价键的分子的中心原子轨道杂化类型
,含极性共价键的分子的中心原子轨道杂化类型
③已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2.T的基态原子外围电子(价电子)排布式为
(3)与N2互为等电子体的分子和离子有(各写一个)
| ||
①除 S 外,上列元素的电负性从大到小依次为
O>N>C>K
O>N>C>K
;②生成物中,A 的电子式为


sp
sp
;③已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为
1:1
1:1
.(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2.T的基态原子外围电子(价电子)排布式为
3d84s2
3d84s2
,Q2+的未成对电子数是4
4
.(3)与N2互为等电子体的分子和离子有(各写一个)
CO
CO
,CN-
CN-
(限用第二周期的元素表示)分析:(1)①、同周期自左而右电负性增大,金属性越强电负性越小,据此解答;
②、由原子守恒可知,物质A为K2S,属于离子化合物,由钾离子与硫离子构成;
含极性共价键的分子为CO2,分子中C原子形成2个C=O键,不含孤对电子,杂化轨道数目为2;
③、CN-与N2结构相似,C原子与N原子之间形成三键,则HCN分子结构式为H-C≡N,三键中含有1个σ键、2个π键,单键属于σ键;
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,则Q、T处于第Ⅷ族,且原子序数T比Q多2,则Q为Fe元素,T为Ni元素,再经过核外电子排布规律解答;
(3)原子数目相同,电子总数(或价电子总数)相等的微粒为等电子体.
②、由原子守恒可知,物质A为K2S,属于离子化合物,由钾离子与硫离子构成;
含极性共价键的分子为CO2,分子中C原子形成2个C=O键,不含孤对电子,杂化轨道数目为2;
③、CN-与N2结构相似,C原子与N原子之间形成三键,则HCN分子结构式为H-C≡N,三键中含有1个σ键、2个π键,单键属于σ键;
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,则Q、T处于第Ⅷ族,且原子序数T比Q多2,则Q为Fe元素,T为Ni元素,再经过核外电子排布规律解答;
(3)原子数目相同,电子总数(或价电子总数)相等的微粒为等电子体.
解答:解:(1)①、同周期自左而右电负性增大,金属性越强电负性越小,故电负性O>N>C>K,
故答案为:O>N>C>K;
②、由原子守恒可知,物质A为K2S,属于离子化合物,由钾离子与硫离子构成,电子式为 ,
,
含极性共价键的分子为CO2,分子中C原子形成2个C=O键,不含孤对电子,杂化轨道数目为2,为sp杂化方式,
故答案为: ;sp;
;sp;
③、CN-与N2结构相似,C原子与N原子之间形成三键,则HCN分子结构式为H-C≡N,三键中含有1个σ键、2个π键,单键属于σ键,故HCN分子中σ键与π键数目之比为1:1,
故答案为:1:1;
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,则Q、T处于第Ⅷ族,且原子序数T比Q多2,则Q为Fe元素,T为Ni元素,Ni元素是28号元素,Ni原子价电子排布式为3d84s2,Fe2+的核外电子排布式为1s24s22p63s23d6,3d能级有4个单电子,
故答案为:3d84s2;4;
(3)与N2互为等电子体的分子和离子有CO,CN-等,故答案为:CO;CN-.
故答案为:O>N>C>K;
②、由原子守恒可知,物质A为K2S,属于离子化合物,由钾离子与硫离子构成,电子式为
 ,
,含极性共价键的分子为CO2,分子中C原子形成2个C=O键,不含孤对电子,杂化轨道数目为2,为sp杂化方式,
故答案为:
 ;sp;
;sp;③、CN-与N2结构相似,C原子与N原子之间形成三键,则HCN分子结构式为H-C≡N,三键中含有1个σ键、2个π键,单键属于σ键,故HCN分子中σ键与π键数目之比为1:1,
故答案为:1:1;
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,则Q、T处于第Ⅷ族,且原子序数T比Q多2,则Q为Fe元素,T为Ni元素,Ni元素是28号元素,Ni原子价电子排布式为3d84s2,Fe2+的核外电子排布式为1s24s22p63s23d6,3d能级有4个单电子,
故答案为:3d84s2;4;
(3)与N2互为等电子体的分子和离子有CO,CN-等,故答案为:CO;CN-.
点评:本题考查电负性、电子式、杂化轨道、原子核外电子排布规律、等电子体等,难度不大,注意对基础知识的理解掌握,注意(2)中元素推断,整体把握元素周期表.

练习册系列答案
相关题目
(3)在CrCl3的水溶液中,一定条件下存在组成为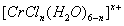 (n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:
(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:
[CrCl3(H2O)6-n]x+ +xR-H Rx[CrCl3(H2O)6-n]x+ +xH+
Rx[CrCl3(H2O)6-n]x+ +xH+
交换出来的经中和滴定,即可求出x和n,确定配离子的组成。
将含0.0015 mol 的溶液,与R-H完全交换后,中和生成的需浓度为0.1200 mol·L-1 NaOH溶液25.00 ml,该配离子的化学式为__________________ 。
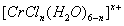 (n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:
(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应: [CrCl3(H2O)6-n]x+ +xR-H
 Rx[CrCl3(H2O)6-n]x+ +xH+
Rx[CrCl3(H2O)6-n]x+ +xH+交换出来的经中和滴定,即可求出x和n,确定配离子的组成。
将含0.0015 mol 的溶液,与R-H完全交换后,中和生成的需浓度为0.1200 mol·L-1 NaOH溶液25.00 ml,该配离子的化学式为__________________ 。
 (1)中国古代四大发明之一--黑火药,它的爆炸反应为:
(1)中国古代四大发明之一--黑火药,它的爆炸反应为: