题目内容
【题目】研究发现艾滋病治疗药物利托那韦对新型冠状病毒也有很好的抑制作用,它的合成中间体2-异丙基-4-(甲基氨基甲基)噻唑可按如下路线合成:

回答下列问题:
(1)A的结构简式是__________,C中官能团的名称为 ______________。
(2)①、⑥的反应类型分别是__________、_____。D的化学名称是______。
(3)E极易水解生成两种酸,写出E与NaOH溶液反应的化学方程式:_______。
(4)H的分子式为 __________________。
(5)I是相对分子质量比有机物 D 大 14 的同系物, 写出I 符合下列条件的所有同分异构体的结构简式:_____________。
①能发生银镜反应 ②与NaOH反应生成两种有机物
(6)设计由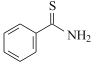 ,和丙烯制备
,和丙烯制备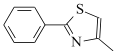 的合成路线______________(无机试剂任选)。
的合成路线______________(无机试剂任选)。
【答案】CH2=CH-CH2Cl 羰基、氯原子 加成反应 取代反应 2-甲基丙酸 ![]() +2NaOH→
+2NaOH→![]() +NaCl+H2O C8H14N2S HCOOCH2CH2CH2CH3、HCOOCH2CH(CH3)2、HCOOCH(CH3)CH2CH3、HCOOC(CH3)3
+NaCl+H2O C8H14N2S HCOOCH2CH2CH2CH3、HCOOCH2CH(CH3)2、HCOOCH(CH3)CH2CH3、HCOOC(CH3)3 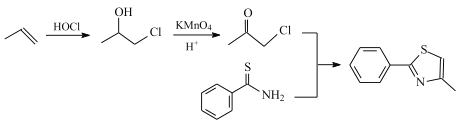
【解析】
根据合成路线中,有机物的结构变化、分子式变化及反应条件分析反应类型及中间产物;根据目标产物及原理的结构特征及合成路线中反应信息分析合成路线;根据结构简式、键线式分析分子式及官能团结构。
(1)根据B的结构及A的分子式分析知,A与HOCl发生加成反应得到B,则A的结构简式是CH2=CH-CH2Cl;C中官能团的名称为羰基、氯原子;故答案为:CH2=CH-CH2Cl;羰基、氯原子;
(2)根据上述分析,反应①为加成反应;比较G和H的结构特点分析,G中氯原子被甲胺基取代,则反应⑥为取代反应;D为![]() ,根据系统命名法命名为2-甲基丙酸;故答案为:加成反应;取代反应;2-甲基丙酸;
,根据系统命名法命名为2-甲基丙酸;故答案为:加成反应;取代反应;2-甲基丙酸;
(3)E水解时C-Cl键发生断裂,在碱性条件下水解生成两种盐,化学方程式为:![]() +2NaOH→
+2NaOH→![]() +NaCl+H2O,故答案为:
+NaCl+H2O,故答案为:![]() +2NaOH→
+2NaOH→![]() +NaCl+H2O;
+NaCl+H2O;
(4)H的键线式为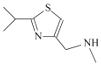 ,则根据C、N、S原子的成键特点分析分子式为C8H14N2S,故答案为:C8H14N2S;
,则根据C、N、S原子的成键特点分析分子式为C8H14N2S,故答案为:C8H14N2S;
(5)I是相对分子质量比有机物 D 大14 的同系物,则I的结构比D多一个CH2原子团;①能发生银镜反应,则结构中含有醛基;②与NaOH反应生成两种有机物,则该有机物为酯;结合分析知该有机物为甲酸某酯,则I结构简式为:HCOOCH2CH2CH2CH3、HCOOCH2CH(CH3)2、HCOOCH(CH3)CH2CH3、HCOOC(CH3)3,故答案为:HCOOCH2CH2CH2CH3、HCOOCH2CH(CH3)2、HCOOCH(CH3)CH2CH3、HCOOC(CH3)3;
(6)根据合成路线图中反应知,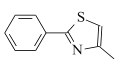 可由
可由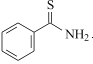 与
与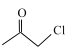 合成得到,
合成得到, 由
由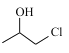 氧化得到,
氧化得到, 可由丙烯加成得到,合成路线为:
可由丙烯加成得到,合成路线为: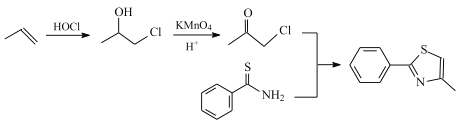 ,故答案为:
,故答案为: 。
。

【题目】已知A(g)+B(g)![]() C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K=___,ΔH___0(填“<”“>”或“=”)。
(2)830℃时,向一个5L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003molL-1s-1,则6s时c(A)=___molL-1,C的物质的量为___mol;若反应经一段时间后,达到平衡时A的转化率为___,如果这时向该密闭容器中再充入1mol氩气,平衡时A的转化率为___。
(3)一定温度下,能判断该反应达化学平衡状态的是___。
①单位时间内生成nmolA,同时消耗nmolC
②A的转化率不变
③容器内压强不再变化
④混合气体的密度不再变化
⑤混合气体的平均相对分子质量不再变化
(4)1200℃时,C(g)+D(g)![]() A(g)+B(g)的平衡常数的值为___。
A(g)+B(g)的平衡常数的值为___。
【题目】研究高效催化剂是解决汽车尾气中的 NO 和 CO 对大气污染的重要途径。
(1)已知:C(s)+O2(g)=CO2(g) △H1=-393.5 kJ/mol
C(s)+![]() O2(g)= CO(g) △H2= -110.5 kJ/mol
O2(g)= CO(g) △H2= -110.5 kJ/mol
N2(g)+ O2(g)=2NO(g) △H3= +180.0 kJ/mol
则汽车尾气的催化转化反应 2NO(g)+ 2CO(g)=N2(g)+ 2CO2(g)的△H =_______kJ/mol。
(2)400℃时,在分别装有催化剂 A 和 B 的两个容积为 2 L 的刚性密闭容器中,各充入物质的量均为nmol的NO和CO发生上述反应。通过测定容器内总压强随时间变化来探究催化剂对反应速率的影响,数据如下表:
时间/min | 0 | 10 | 20 | 30 | ∞ |
A容器内压强/kPa | 75.0 | 70.0 | 65.0 | 60.0 | 60.0 |
B容器内压强/kPa | 75.0 | 71.0 | 68.0 | 66.0 | 60.0 |
①由上表可以判断催化剂 __________(填“A”或“B”) 的效果更好。
②容器中CO 的平衡转化率为 __________。400℃时,用压强表示的平衡常数Kp__________(kPa)-1 (保留两位小数)。
③汽车尾气排气管中使用催化剂可以提高污染物转化率,其原因是 __________。
(3)为研究气缸中NO的生成, 在体积可变的恒压密闭容器中,高温下充入物质的量均为 1mol 的氮气和氧气,发生反应 N2(g)+ O2(g)2NO(g)。
①下列说法能表明该反应已经达到平衡状态的是_________(填序号)。
A.2v正(O2)= v逆(NO) B.混合气体的平均相对分子质量不变
C.c(N2):c(O2)=l D.容器内温度不变
②为减小平衡混合气中 NO 的体积分数, 可采取的措施是 ___________。
(4)对于缸中NO的生成,化学家提出了如下反应历程:
第一步 O22O 慢反应
第二步 O+N2NO+N 较快平衡
第三步 N+O2NO+O 快速平衡
下列说法错误的是_______(填标号)。
A.第一步反应不从N2分解开始,是因为N2比O2稳定
B.N、O 原子均为该反应的催化剂
C.三步反应中第一步反应活化能最大
D.三步反应的速率都随温度升高而增大