��Ŀ����
t��ʱ����3mol A��1molB����ͨ�����Ϊ2L���ܱ������У��ݻ����䣩���������·�Ӧ��
3A��g�� + B(g)  xC(g)2minʱ��Ӧ�ﵽƽ��״̬���¶Ȳ��䣩��ʣ����0.8molB,�����C��Ũ��Ϊ0.4mol/L,����д���пհ�:
xC(g)2minʱ��Ӧ�ﵽƽ��״̬���¶Ȳ��䣩��ʣ����0.8molB,�����C��Ũ��Ϊ0.4mol/L,����д���пհ�:
(1)�ӿ�ʼ��Ӧ���ﵽƽ���״̬,����Cƽ����Ӧ����Ϊ .
(2)x= ;ƽ�ⳣ��K= .
(3)��������ԭ������������ͨ����������(�躤����A��B��C������Ӧ)��ѧƽ�⣨����ĸ�� ��A��������Ӧ�����ƶ� B�����淴Ӧ�����ƶ� C��ƽ�ⲻ�ƶ�
��4������ԭƽ��������������ٳ���amolC����t��ʱ�ﵽ��ƽ�⣬��ʱB�����ʵ���Ϊ
n��B��= mol��
��5�����������Ӧ����ͬ�¶Ⱥ������н��У���ʹ��Ӧ�ﵽC�����ʵ���������ԭƽ����ȣ���ʼ������������ʵ����ʵ���n��A����n��B����n��C��֮��Ӧ������Ĺ�ϵʽΪ�� ��
(1)0.2mol/(L��min) (2) 4 1/27(��0.037) (3)C (4)0.8 + 0.2a (5)n(A)/n(B) ��3/1,n(C)��0
���������������1��C��Ũ��Ϊ0.4mol/L��������C�ķ�Ӧ������0.4mol/L��2min��0.2mol/(L��min)��
��2������B�����ʵ�����0.2mol����Ũ����0.1mol/L�������Ũ�ȵı仯��֮������Ӧ�Ļ�ѧ������֮�ȿ�֪��x��4��ƽ��ʱʣ��A�����ʵ�����3mol��0.6mol��2.4mol����Ũ����1.2mol/L������ƽ�ⳣ��K��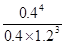 ��
��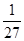 ��
��
��3�����������뷴Ӧ������ƽ�ⲻ�ƶ�����ѡC��
��4�����ڷ�Ӧǰ��������䣬����ԭƽ��������������ٳ���amolC����ƽ���ǵ�Ч�ģ�������t��ʱ�ﵽ��ƽ�⣬��ʱB�����ʵ���Ϊ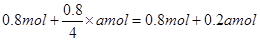 ��
��
��5�����ڷ�Ӧǰ��������䣬���Чƽ��������ǵ�Чת����ֻҪ��Ӧ�������������ʵ����ı�����ԭƽ����ʼ̬��ͬ����ƽ���Ч�������������ʵ����ʵ���n��A����n��B����n��C��֮��Ӧ������Ĺ�ϵʽΪn(A)/n(B) ��3/1��n(C)��0��
���㣺���鷴Ӧ���ʡ�ƽ�ⳣ�����㣬���������ƽ��״̬��Ӱ���Լ���Чƽ����й��ж�
�������������е��Ѷȵ����⣬�����ۺ���ǿ����ѧ����˼ά��������˸��ߵ�Ҫ�������ڲ��ض�ѧ������֪ʶ���̺�ѵ����ͬʱ�����ض�ѧ�������������ͽ��ⷽ����ָ����ѵ��������Ĺؼ�����ȷƽ�ⳣ���͵�Чƽ��ĺ����Լ�Ӱ�����أ�Ȼ�����ݷ���ʽ������ü��ɡ�����������ѧ�������������������ѧ�����������ɡ��ܽ������������

 xC(g)��2minʱ��Ӧ����ƽ��״̬���¶Ȳ��䣩����ʱ������ʣ����0.8mol B,�����C��Ũ��Ϊ0.4mol��L-1������д���пհף�
xC(g)��2minʱ��Ӧ����ƽ��״̬���¶Ȳ��䣩����ʱ������ʣ����0.8mol B,�����C��Ũ��Ϊ0.4mol��L-1������д���пհף�