题目内容
(12分)下图中A~J分别代表相关反应中的一种物质,已知A分解得到等物质的量的B、C、D,已知B、D为常温下的气态化合物,C为常温下的液态化合物,图中有部分生成物未标出。
请填写以下空白:
(1)A的化学式为 ,B的电子式为 。
(2)写出下列反应的化学方程式:
D+G→H 。
F+J→B+C+I 。
(3)0.3 mol I与足量C反应转移电子的物质的量为 mol。
(4)容积为10 mL的试管中充满I和G的混合气体,倒立于盛水的水槽中,水全部充满试管,则原混合气体中I与G的体积分别为 mL, mL。
(1) NH4HCO3(2分),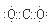 (2分)
(2分)
(2)4NH3+5O2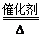 4NO+6H2O (2分) C+4HNO3(浓)
4NO+6H2O (2分) C+4HNO3(浓)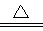 =CO2↑+4NO2↑+2H2O(2分)
=CO2↑+4NO2↑+2H2O(2分)
(3)0.2(2分)
(4)8(1分)2(1分)
解析试题分析:(1)已知A分解得到等物质的量的B、C、D,分析反应特点判断A是碳酸氢铵,化学式为NH4HCO3,镁条在B中燃烧,说明B是二氧化碳,则B的电子式为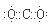 ;
;
(2)铵盐与碱共热得D为氨气,过氧化钠与水反应生成G氧气,所以氨气与氧气的催化氧化反应的化学方程式为4NH3+5O2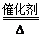 4NO+6H2O ;J为硝酸,F为碳单质,所以F+J→B+C+I的化学方程式为C+4HNO3(浓)
4NO+6H2O ;J为硝酸,F为碳单质,所以F+J→B+C+I的化学方程式为C+4HNO3(浓) =CO2↑+4NO2↑+2H2O(2分);
=CO2↑+4NO2↑+2H2O(2分);
(3)I为NO2,与水的反应:3NO2+H2O=2HNO3+NO既作氧化剂又作还原剂,所以0.3mol的NO2与水的反应中转移电子的物质的量是0.2mol,
(4)NO2与O2恰好反应时物质的量之比是4:1,所以10mL混合气体中有8mL NO2,2mL O2
考点:考查物质推断,电子式、化学方程式的书写,氧化还原反应的计算

 阅读快车系列答案
阅读快车系列答案硅是重要的半导体材料,构成了现代电子工业的基础。回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号 ,该能层具有的原子轨道数为 、电子数为 。
(2)硅主要以硅酸盐、 等化合物的形式存在于地壳中。
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以 相结合,其晶胞中共有8个原子,其中在面心位置贡献 个原子。
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备。工业上采用Mg2Si和NH4CI在液氨介质中反应制得SiH4,该反应的化学方程式为 。
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
| 化学键 | C-C | C-H | C-O | Si-Si | Si-H | Si-O |
| 键能(KJ/mol) | 356 | 413 | 336 | 226 | 318 | 452 |
②SiH4的稳定性小于CH4,更易生成氧化物,原因是 。
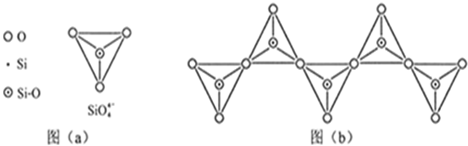
(6)在硅酸盐中,SiO44-四面体(如下图a)通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图b为一种无限长单链结构的多硅酸根;其中Si原子的杂化形式为 。Si与O的原子数之比为 化学式为 。
下表是实验室制备气体的有关内容:
| 编号 | 实验内容 | 实验原理 | 气体发生装置 |
| ① | 制氧气 | H2O2―→O2 | |
| ② | 制氨气 | NH4Cl―→NH3 | |
| ③ | 是氯气 | HCl―→Cl2 | |
(1)上表气体中:从制备过程看,必须选择合适的氧化剂才能实现的是________(填气体的化学式,下同);从反应原理看,明显不同于其他两种气体的是________。
(2)根据表中所列实验原理,从下列装置中选择合适的气体发生装置,将其编号填入上表中的空格中。

(3)若用上述制备O2的装置制备NH3,则选择的试剂为________________。
(4)制备Cl2需用8 mol·L-1的盐酸100 mL,现用12 mol·L-1的盐酸来配制。
①为提高配制的精确度,量取浓盐酸的仪器可选用下列中的________(填序号):

②配制过程中,除上图所列仪器外,还需要的仪器有________、________、________。
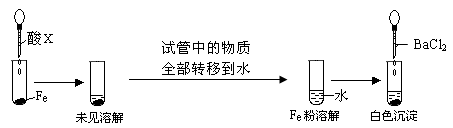


 8SO2+2Fe2O3,该反应中被氧化的元素是 (填元素符号)。当该反应转移2.75 mol电子时,生成的二氧化硫在标准状况下的体积为 L。
8SO2+2Fe2O3,该反应中被氧化的元素是 (填元素符号)。当该反应转移2.75 mol电子时,生成的二氧化硫在标准状况下的体积为 L。 

