��Ŀ����
����Ŀ��������ѧ֪ʶ�����Ŀ��
��1������пƬ�ʹ�ͭƬ����ͼ��ʽ������ͬŨ�ȵ�ϡ������һ��ʱ�䣬�ش��������⣺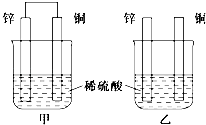
������˵������ȷ����������ţ���
A���ס��Ҿ�Ϊ��ѧ��ת��Ϊ���ܵ�װ��
B������ͭƬ��û�����Ա仯
C������ͭƬ�������١�����пƬ��������
D�����ձ���H+��Ũ�Ⱦ���С
������ͬʱ���ڣ����ձ��в������ݵ����ʣ����ң����������������=������
�ۼ�����������������ƶ����ͭ����п����
�ܵ����в���1.12L����״��������ʱ��������ͨ�����ߵĵ�����ĿΪ ��
��2��������Ӧ2Fe3++Cu�TCu2++2Fe2+��Ƴ�ԭ��أ��õ�ظ�������Ϊ �� �������ҺΪ �� ������ӦΪ �� 10min�ڸõ�������ṩ0.1mol���ӣ������������븺�����ϵ�������Ϊg������տ�ʼʱ�����缫��������ȣ���
���𰸡�
��1��BD�������0.1NA��6.02��1022
��2��Cu���Ȼ�����Һ��Fe3++e���TFe2+��3.2
���������⣺��1����A������ԭ��ع�����������������ԭ��أ��Ҳ��ܹ��ɱպϻ�·�����Բ��ܹ���ԭ��أ���A����B���Ҳ��ܹ���ԭ��أ���������пƬ�ϵõ��ӷ�����ԭ��Ӧ����������ͭƬ��û�����Ա仯����B��ȷ��C������ͭƬ�������������������ӵõ�����������������ͭƬ�������䣬����пƬ�������ӷ����û���Ӧ�������������٣���C����D�����ձ���п�������ӷ����û���Ӧ������Һ��������Ũ�ȼ�С��������Һ��pH������D��ȷ�����Դ��ǣ�BD���ڼ��ܹ���ԭ��أ��Ҳ��ܹ���ԭ��أ���ԭ��ظ����Ľ������ٱ���ʴ����������ͬʱ���ڣ����ձ��в������ݵ��ٶȣ��ף��ң����Դ��ǣ�������пΪ�����������������п���ƶ��������Դ��ǣ�п���ܼ��У�ͭ�缫�������ӵõ��������������缫��ӦʽΪ2H++2e��=H2�������ݵ缫��Ӧʽ֪��ͨ�����ӵ����ʵ���= ![]() =��2=0.1mol��ͨ�����ߵĵ�����ĿΪ0.1NA��6.02��1022 �� ���Դ��ǣ�0.1NA��6.02��1022����2�����ݵ�ط�Ӧʽ֪��Cuʧ���ӷ���������Ӧ����������������Cu���õĽ�����ķǽ��������������������ӵĿ�����������ҺΪ�������Һ����FeCl3��Һ�� ������ӦʽΪCu��2e��=Cu2+ �� ������ͭʧ��������ͭ���ӽ�����Һ������ͭ�����ڲ��ϼ��٣�����ת�Ƶ�����Cu�Ĺ�ϵʽ������Cu������=
=��2=0.1mol��ͨ�����ߵĵ�����ĿΪ0.1NA��6.02��1022 �� ���Դ��ǣ�0.1NA��6.02��1022����2�����ݵ�ط�Ӧʽ֪��Cuʧ���ӷ���������Ӧ����������������Cu���õĽ�����ķǽ��������������������ӵĿ�����������ҺΪ�������Һ����FeCl3��Һ�� ������ӦʽΪCu��2e��=Cu2+ �� ������ͭʧ��������ͭ���ӽ�����Һ������ͭ�����ڲ��ϼ��٣�����ת�Ƶ�����Cu�Ĺ�ϵʽ������Cu������= ![]() ��64g/mol=3.2g�����Դ��ǣ�Cu���Ȼ�����Һ��Fe3++e���TFe2+��3.2��
��64g/mol=3.2g�����Դ��ǣ�Cu���Ȼ�����Һ��Fe3++e���TFe2+��3.2��