题目内容
【题目】降低太气中CO2含量及有效开发利用CO2 , 是科学家研究的重要课题.
(1)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g)△H=122.4kJmol﹣1
①某温度下,将2.0molCO2(g)和6.0molH2(g)充入体积可变的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中.CH3OCH3(g)的物质的量分数变化如下表所示.
P1 | P2 | P3 | |
T1 | 0.10 | 0.04 | 0.02 |
T2 | 0.20 | 0.16 | 0.05 |
T3 | 0.40 | 0.35 | 0.20 |
则P1P3 (填“>”“<”或“=”,下同).若T1、P1 , T3、P3时平衡常数分别为K1、K3 , 则K1K3 . T1、P1时H2的平衡转化率为 .
②一定条件下,上述反应在密闭容器中达平衡.当仅改变影响反应的一个条件,引起的下列变化能说明平衡一定向正反应方向移动的是 .
a.反应物的浓度降低
b.容器内压强增大
c.正反应速率大于逆反应速率
d.化学平衡常数K增大
(2)碳酸氢钾溶液加水稀释, ![]() (填“增大”“不变”或“减小”).用碳酸钾溶液吸收空气中CO2 , 当溶液呈中性时,下列关系或说法正确的是: . a.c(K+)=2c(CO32﹣)+c(HCO3﹣)+c(H2CO3)
(填“增大”“不变”或“减小”).用碳酸钾溶液吸收空气中CO2 , 当溶液呈中性时,下列关系或说法正确的是: . a.c(K+)=2c(CO32﹣)+c(HCO3﹣)+c(H2CO3)
b.c(HCO3﹣)>c(CO32﹣)
c.降低温度,c(H+)c(OH﹣)不变
(3)向盛有FeCl3溶液的试管中滴加少量碳酸钾溶液,立即产生气体,溶液颜色加深,用激光笔照射能产生丁达尔效应,反应的离子方程式为 .
【答案】
(1)>;<;57.14%;cd
(2)增大;b
(3)2Fe3++3CO32﹣+3H2O=2Fe(OH)3(胶体)+3CO2↑
【解析】解:(1)①2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g)△H=﹣122.4kJmol﹣1 , 反应是气体体积减小的反应,增大压强平衡正向进行,平衡体系中CH3OCH3(g)的物质的量分数增大,P1、P2、P3分析数值变化可知,平衡体系中CH3OCH3(g)的物质的量分数减小,说明平衡逆向进行,压强减小P1>P3 , 反应是放热反应,温度越高,平衡逆向进行,平衡体系中CH3OCH3(g)的物质的量分数减小,平衡常数随温度变化,若T1、Pl , T3、P3时平衡常数分别为K1、K3 , 依据数据分析,T1>T3 , K1<K3;依据化学平衡三段式列式计算T1、Pl时H2的平衡转化率,设氢气转化率为x;
2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g)
起始量(mol) 26 0 0
变化量(mol) ![]() x x
x x ![]() x
x ![]() x
x
平衡量(mol)2﹣ ![]() x 6﹣x
x 6﹣x ![]() x
x ![]() x
x
甲醚物质的量分数= 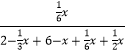 ×100%=0.10
×100%=0.10
x= ![]() mol
mol
转化率= ![]()
![]() =×100%=57.14%;
=×100%=57.14%;
所以答案是:<;>;57.14%;
②平衡一定向正反应方向移动,利用反应是气体体积减小的放热反应,增大压强、降低温度、减少生成物促进平衡正向进行;
a.反应物的浓度降低,平衡逆向进行,故a不符合;
b.容器内压强增大,平衡向气体体积减小的方向进行,即正反应方向进行,若恒温恒容容器中加入惰气,压强增大,平衡不动,故b不符合;
c.正反应速率大于逆反应速率,反应一定正向进行,故c符合;
d.化学平衡常数K增大,说明反应正向进行,故d符合;
故选cd;(2)碳酸氢钾溶液中碳酸氢根离子水解显碱性,HCO3﹣+H2OH2CO3+OH﹣ , HCO3﹣H++CO32﹣ , 变式比值同乘以氢离子浓度得到 ![]() =
= ![]() ,溶液呈碱性,加入水稀释,氢氧根离子浓度减小,依据离子积常数可知,溶液中氢离子浓度增大,比值增大;
,溶液呈碱性,加入水稀释,氢氧根离子浓度减小,依据离子积常数可知,溶液中氢离子浓度增大,比值增大;
a、当溶渡呈中性时溶液中存在电荷守恒分析,溶液中存在物料守恒为:c(K+)+c(H+)=2c(CO32﹣span>)+c(HCO3﹣)+c(OH﹣),得到c(K+)=2c(CO32﹣)+c(HCO3﹣),故a错误;
b、中性溶液中存在碳酸氢根离子和碳酸溶液,溶液中碳酸电离生成碳酸氢根离子和氢离子,碳酸氢根离子发生微弱的水解,溶液中存在c(HCO3﹣)>c(CO32﹣),故b正确;
c、溶液中离子积随温度变化,降低温度,离子积发生变化,故c错误;
故选b;
所以答案是:增大;b;(3)向盛有FeCl3溶液的试管中滴加少量碳酸钾溶液,碳酸根离子和铁离子发生双水解反应生成氢氧化铁胶体和二氧化碳,反应的离子方程式为:2Fe3++3CO32﹣+3H2O=2Fe(OH)3(胶体)+3CO2↑,
所以答案是:2Fe3++3CO32﹣+3H2O=2Fe(OH)3(胶体)+3CO2↑.
【考点精析】本题主要考查了化学平衡状态本质及特征的相关知识点,需要掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效)才能正确解答此题.

 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案【题目】工业上合成尿素的反应:2NH3(g)+CO2(g)CO(NH2)2(I)+H2O(I)△H(I)
(1)已知合成尿素的反应分两步进行:2NH3(g)+CO2(g)NH2COONH4(s)△H1
NH2COONH4(s)CO(NH2)2(I)+H2O(I)△H2
其能量变化曲线如图1所示,则△H、△H1和△H2由大到小的顺序为 . 
(2)在一个真空恒容密闭容器中充入CO2和NH3发生反应(I)合成尿素,恒定温度下混合气体中NH3的体积分数如图2所示.A点的正反应速率v正(CO2)B点的逆反应速率v逆(CO2)(填“>”、“<”或“=”);CO2的平衡转化率为 .
(3)将一定量的氨基甲酸铵固体置于恒容真空容器中,发生反应:H2NCOONH4(s)2NH3(g)+CO2(g).在不同温度(T1和T2)下,该反应达平衡状态时部分数据见下表.
温度 | 平衡浓度/(molL﹣1) | |
c(NH3) | c(CO2) | |
T1 | 0.1 | |
T2 | 0.1 | |
①T1T2 (填“>”、“<”或“=”).
②下列能说明该分解反应达到平衡状态的是(填代号).
a.v生成(NH3)=2v消耗(CO2)
b.密闭容器内物质的总质量不变
c.密闭容器中混合气体的密度不变
d.密闭容器中氨气的体积分数不变
(4)氨基甲酸铵极易水解成碳酸铵,酸性条件下水解更彻底.25℃时,向1L 0.1molL﹣1的盐酸中逐渐加入氨基甲酸铵粉末至溶液呈中性(忽略溶液体积变化),共用去0.052mol氨基甲酸铵,此时溶液中几乎不含碳元素.此时溶液中c(NH4+)=;NH4+水解平衡常数值为 .
【题目】能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
(1)工业上一般采用下列两种反应合成甲醇:反应Ⅰ:CO(g)+2H2(g)CH3OH(g)△H1
反应Ⅱ:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H2
①上述反应符合“原子经济”原则的是(填“I”或“Ⅱ”).
②下表所列数据是反应I在不同温度下的化学平衡常数(K).
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
由表中数据判断△H10 (填“>”、“=”或“<”).
③某温度下,将2mol CO和6molH2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则CO的转化率为 , 此时的温度为(从上表中选择).
(2)已知在常温常压下:①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=﹣1275.6kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=﹣566.0kJ/mol
③H2O(g)=H2O(l)△H=﹣44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置.
①该电池正极的电极反应为 .
②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为 .


