题目内容
【题目】用下列实验装置能达到所述的实验目的是( ) 
A.利用装置甲既可以进行石油的分馏,也可以进行酒精的浓缩
B.利用装置乙可以完成实验室制备乙烯气体并检验乙烯气体的生成
C.利用装置丙可以完成实验室制备乙炔气体并检验乙炔气体的生成
D.利用装置丁可以完成实验室制备乙酸乙酯并收集较为纯净的乙酸乙酯
【答案】C
【解析】解:A.蒸馏时温度计应位于蒸馏烧瓶的支管口,用于测量馏分的温度,故A错误;
B.制备乙烯时,因乙醇易挥发,则乙烯中混有乙醇,可被酸性高锰酸钾氧化,则检验乙烯,应排出乙醇的影响,应先除杂,故B错误;
C.饱和食盐水和碳化钙反应生成乙炔,硫酸铜可除去硫化氢、磷化氢等杂质,乙炔可被酸性高锰酸钾氧化,则酸性高锰酸钾可检验乙炔,故C正确;
D.乙酸乙酯中混有乙醇、乙酸,乙醇易溶于水,乙酸与碳酸钠反应,则制备乙酸乙酯时应防止倒吸,导管不能插入液面以下,故D错误.
故选C.

【题目】研究碳及其化合物的相互转化对能源的充分利用、低碳经济有着重要的作用.
(1)已知:①CH4(g)+H2O(g)CO(g)+3H2(g)△H1=+206.1kJmol﹣1
②2H2(g)+CO(g)CH3OH(l)△H2=﹣128.3kJmol﹣1
③2H2(g)+O2(g)2H2O (g)△H3=﹣483.6kJmol﹣1
25℃时,在合适的催化剂作用下,采用甲烷和氧气一步合成液态甲醇的热化学方程式为 .
(2)利用反应①来制备氢气,为了探究温度、压强对反应①速率、转化率的影响,某同学设计了以下三组对比实验(温度为400℃或500℃,压强为101kPa或404kPa).
实验序号 | 温度℃ | 压强/kPa | CH4初始浓度/molL﹣1 | H2O初始浓度/molL﹣1 |
1 | 400 | p | 3.0 | 7.0 |
2 | t | 101 | 3.0 | 7.0 |
3 | 400 | 101 | 3.0 | 7.0 |
①实验2和实验3相比,其平衡常数关系是K2K3(填“>”、“<”或“=”).
②将等物质的量的CH4和水蒸气充入1L恒容密闭容器中,发生上述反应,在400℃下达到平衡,平衡常数K=27,此时容器中CO物质的量为0.10mol,则CH4的转化率为 .
(3)科学家提出由CO2制 取 C的太阳能工艺如图1所示.
①“重整系统”发生的反应中n(FeO):n(CO2)=6:1,则Fe xOy的化学式为 .
②“热分解系统”中每分解l mol Fe xOy , 转移电子的物质的量为 . 
(4)pC类似pH,是指极稀溶液中的溶质浓度的常用负对数值.若某溶液中溶质的浓度为1×10﹣3molL﹣1 , 则该溶液中溶质的pC=﹣lg(1×10﹣3)=3.如图2为25℃时H2CO3溶液的pC﹣pH图.请回答下列问题 (若离子浓度小于10﹣5mol/L,可认为该离子不存在):
①在同一溶液中,H2CO3、HCO3﹣、CO32﹣(填“能”或“不能”)大量共存.
②求H2CO3一级电离平衡常数的数值Ka1= .
③人体血液里主要通过碳酸氢盐缓冲体系 ![]() 可以抵消少量酸或碱,维持pH=7.4.当过量的酸进入血液中时,血液缓冲体系中的
可以抵消少量酸或碱,维持pH=7.4.当过量的酸进入血液中时,血液缓冲体系中的 ![]() 最终将 .
最终将 .
A.变大B.变小C.基本不变D.无法判断.
【题目】二氧化碳是全球气候变化的主要罪魁祸首,为消除二氧化碳的污染并使其转变为有用物质,全世界的化学科学家做了大量的研究.科学家找到了一种名叫二硒化钨的金属化合物,通过处理,在阳光作用下,使二氧化碳较易分解成一氧化碳和氧气,用一氧化碳可轻松获得多种能源物质.如CO和H2可以合成甲醇.
在10L的密闭容器中按物质的量之比1:2充入CO和H2 , 若充有10molCO发生反应:CO(g)+2H2(g)CH3OH(g).
测得平衡时CO的转化率隨温度变化及压强的变化如图所示: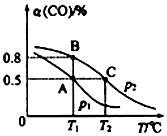
p2、T2时,n(CO)随时间的变化如表所示:
t/min | 0 | 1 | 3 | 5 |
n(CO)/mol | 10 | 7 | 5 | 5 |
(1)p2、T2时,0~lmin 内,平均速率ν(H2)=mol/(Lmin);
(2)你认为p1p2(填“<”“>”或“=”)
(3)合成甲醇的反应为(填“放热”或“吸热”)反应.A、B、C三点的平衡常数KA、KB、KC的大小关系为 .
(4)若工业生产CH3OH,下列措施中,能增加单位时间内CH3OH产量的方法有 .
①增大压强 ②降低温度 ③升高温度
④加入催化剂 ⑤适当增大一氧化碳的比例量 ⑥及时分离CH3OH
(5)己知碳的燃烧热为Q1kJ/mol,碳与氧气反应生成一氧化碳(按量筒整数比)的反应热为﹣Q2J/mol,则二氧化碳在二硒化钨作催化剂时分解的热化学方程式(按最简整数比)为: .

