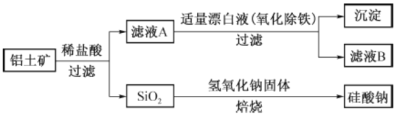
题目内容
【题目】某实验小组对一含有Al3+的未知溶液进行了如下分析:
①滴入少量氢氧化钠,无明显变化;
②继续滴加NaOH溶液,有白色沉淀;
③滴入过量的氢氧化钠,白色沉淀明显减少。
实验小组经定量分析,得出如图所示沉淀与滴人氢氧化钠体积 的关系。下列说法错误的是( )
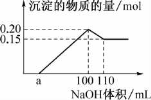
A.该未知溶液中至少含有3种阳离子
B.滴加的NaOH溶液的物质的量浓度为5 molL-1
C.若另一种离子为二价阳离子,则a=10
D.若将最终沉淀过滤、洗涤、灼烧,其质量一定为6 g
【答案】D
【解析】
试题分析:①滴入NaOH无明显变化,说明溶液中含有H+,发生H++OH-=H2O,②继续滴加NaOH,有白色沉淀,说明可能含有金属阳离子;③继续加入NaOH,白色沉淀明显减少,但不完全消失,说明溶液一定含有Al3+和金属阳离子;A、根据上述推断,至少含有三种阳离子,故说法正确;B、沉淀减少的离子反应方程式:Al(OH)3+OH- = AlO2-+2H2O,沉淀物质的量减少(0.2-0.15)mol = 0.05mol,这是氢氧化铝的物质的量,因此c(NaOH) = 0.05 / (110-100) × 10-3 mol·L-1 = 5 mol·L-1,故说法正确;C、另一种离子为二价阳离子,假设为Mg2+,从开始出现沉淀到沉淀最大,发生的反应是:Al3+ + 3OH- = Al(OH)3↓,Mg2++2OH- = Mg(OH)2↓,根据铝元素守恒,n(Al3+) = 0.05mol,0.15mol沉淀为Mg(OH)2,根据镁元素守恒n(Mg2+) = 0.15mol,此阶段共消耗的NaOH的物质的量为:(3 ×0 .05 + 0.15 × 2)mol = 0.45mol,消耗氢氧化钠的体积为0.45/5L = 0.09L,合90mL,即a = 10,故说法正确;D、不清楚最终沉淀物质是哪种,无法计算质量,故说法错误。

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案