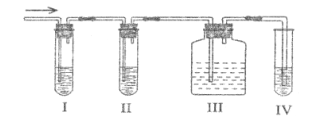
��Ŀ����
����Ŀ���±��Dz�ͬ�¶���ˮ�ĵ�������ݣ�
�¶�/�� | 25 | T1 | T2 |
ˮ�����ӻ� | 1��10-14 | a | 1��10-11 |
�Իش��������⣺
��1����25��T1��T2����a________1��10��14(������������������������)��
��2��25��ʱ��ijNa2SO4��Һ��c(SO)��5��10��4 mol/L��ȡ����Һ1 mL��ˮϡ����10 mL����ϡ�ͺ���Һ��c(Na��)��c(OH��)��________��
��3����T2/���²��ij��ҺpH��7������Һ��______(������������������������)���������¶���pH��11��NaOH��Һa L��pH��1��b LH2SO4��Һ����������û��ҺpH��2����a��b��________�������Ի�Ϻ���Һ����仯����
���𰸡� > 1000��1 �� 9��101
��������(1)ˮ��������ʣ����ڵ���ƽ�⣬�������ȣ������¶����ߣ�ˮ�ĵ���̶��������ӻ�������a��1��10��14��
(2)25��ʱ��ijNa2SO4��Һ��c(SO42-)=5��10-4 mol/L������Һ��������Ũ����1��10-3 mol/L�����ϡ��10������������Ũ����1��10-4 mol/L������������Һ�������Եģ�����c(Na+)��c(OH-)=10-4��10-7=1000��1��
(3)��T2���£�ˮ�����ӻ�Ϊ1��10-11�����¶���������Һ��pH=5.5����ij��ҺpH��7��5.5������Һ�Լ��������¶���aLpH��11��NaOH��Һ������������Ũ��Ϊ1mol/L��bLpH=1��������Һ��������Ũ��Ϊ0.1mol/L�����û����Һ��pH=2��˵��ϡ���������������![]() =0.01mol/L�����a��b��9:101��
=0.01mol/L�����a��b��9:101��