题目内容
【题目】某硫酸厂拟用烟气处理含Cr2O72﹣的酸性废水,在脱硫的同时制备Cr2O3产品.具体流程如下: 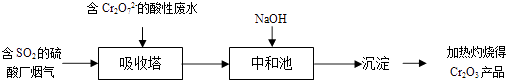
已知吸收塔中反应后的铬元素以Cr3+形式存在,下列说法中正确的是( )
A.吸收塔中的硫元素可能以单质形式存在
B.中和池中只发生生成沉淀的复分解反应
C.在中和池中加入盐酸酸化的BaCl2溶液,可能产生白色沉淀
D.由题意分析得到,沉淀可能是Cr(OH)6
【答案】C
【解析】解:吸收塔中二氧化硫与Cr2O72﹣离子发生氧化还原反应:Cr2O72﹣+2H++3SO2═2Cr3++3SO42﹣+H2O,在中和池中氢氧化钠与酸的中和反应、氢氧根离子与Cr3+离子生成是Cr(OH)3沉淀,Cr(OH)3加热分解得到Cr2O3 . A.反应中Cr元素化合价降低,根据电子转移守恒,S元素化合价升高,不可能以S元素不可能以单质形式存在,反应生成SO42﹣ , 故A错误;
B.中和池中出来发生生成沉淀的复分解反应外,还发生酸碱中和反应,故B错误;
C.中和池中反应后的溶液中含有SO42﹣ , 加入盐酸酸化的BaCl2溶液,可能产生硫酸钡白色沉淀,故C正确;
D.由上述分析可知,得到的沉淀为Cr(OH)3 , 故D错误,
故选:C.

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案【题目】下表是不同温度下水的电离积数据:
温度/℃ | 25 | T1 | T2 |
水的离子积 | 1×10-14 | a | 1×10-11 |
试回答以下问题:
(1)若25<T1<T2,则a________1×10-14(填“>”、“<”或“=”)。
(2)25℃时,某Na2SO4溶液中c(SO)=5×10-4 mol/L,取该溶液1 mL加水稀释至10 mL,则稀释后溶液中c(Na+)∶c(OH-)=________。
(3)在T2/℃下测得某溶液pH=7,该溶液显______(填“酸”、“碱”或“中”)性。将此温度下pH=11的NaOH溶液a L与pH=1的b LH2SO4溶液混合,若所得混合液pH=2,则a∶b=________。(忽略混合后溶液体积变化)。
