题目内容
【题目】化合物M(C16H14O2)是一种香料,工业上利用烃A和甲苯为主要原料,按下列路线合成:
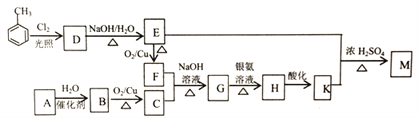
已知:①气态烃A在标准状况下的密度是1.25g/L,能作为果实催熟剂
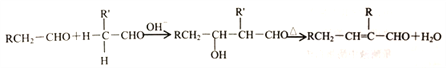
②醛在碱性溶液中能发生羟醛缩合反应,再脱水生成不饱和醛:
请回答下列问题:
(1)K的名称是_______;G中含有的官能团名称是_______ 。
(2)写出D→E的化学方程式_______ 。
(3)A-B的反应类型是_______;M的结构简式是_______ 。
(4)同时满足下列三个条件的K的同分异构体有_____种(不考虑立体异构)。
①遇FeCl溶液发生显色反应;
②能发生银镜反应;
③除苯环以外不再含有其他环状结构。
其中核磁共振氢谱为五组峰的结构简式为_______。
(5)以乙醇为起始原料,选用必要的无机试剂合成1-丁烯,完善以下合成路线(用结构简式表示有机物,箭头上注明试剂和反应条件)______。
CH3CH2OH![]() CH3CHO
CH3CHO![]() ……
……![]() ……
……![]() CH3CH2CH=CH2
CH3CH2CH=CH2
【答案】 苯丙烯酸 碳碳双键、醛基 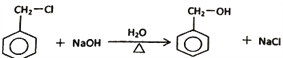 加成反应
加成反应 ![]() 16
16 ![]()
![]()
【解析】气态烃A在标准状况下的密度是1.25g/L,则M=1.25g/L×22.4L/mol=28g/mol,能作为果实催熟剂,则A为乙烯,结构简式为CH2=CH2,CH2=CH2与水在催化剂作用下发生加成反应生成B为乙醇,乙醇在铜的催化下与氧气发生氧化反应生成C为乙醛;甲苯在光照条件下与氯气发生取代反应生成D为![]() ,
,![]() 在氢氧化钠溶液中加热发生取代反应生成E为
在氢氧化钠溶液中加热发生取代反应生成E为![]() ,
,![]() 在铜的催化下与氧气发生氧化反应生成F为苯甲醛,苯甲醛和乙醛在氢氧化钠溶液中加热发生类似
在铜的催化下与氧气发生氧化反应生成F为苯甲醛,苯甲醛和乙醛在氢氧化钠溶液中加热发生类似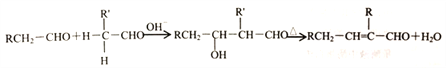 的反应,生成G为
的反应,生成G为![]() ,
,![]() 发生银镜反应生成H为
发生银镜反应生成H为![]() ,
,![]() 酸化生成K为
酸化生成K为![]() ,
,![]() 与
与![]() 在浓硫酸催化下发生酯化反应生成M为
在浓硫酸催化下发生酯化反应生成M为![]() 。(1) K为
。(1) K为![]() ,名称是苯丙烯酸;G为
,名称是苯丙烯酸;G为![]() ,含有的官能团名称是碳碳双键、醛基;(2) D→E的化学方程式为
,含有的官能团名称是碳碳双键、醛基;(2) D→E的化学方程式为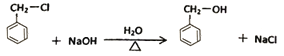 ;(3)A-B是CH2=CH2与水在催化剂作用下发生加成反应生成乙醇,反应类型是加成反应;M的结构简式是
;(3)A-B是CH2=CH2与水在催化剂作用下发生加成反应生成乙醇,反应类型是加成反应;M的结构简式是![]() ;(4)K为
;(4)K为![]() ,同时满足条件的同分异构体:①遇FeCl3溶液发生显色反应则含有酚羟基;②能发生银镜反应则含有醛基;③除苯环以外不再含有其他环状结构,若苯环上只有两个取代基,则为酚羟基和-CH=CHCHO或酚羟基和-C(CHO)=CH2,位置上有邻、间、对位,故有6种同分异构体; 若苯环上有三个取代基则为酚羟基、-CH=CH2、-CHO,先定酚羟基、-CH=CH2在苯环上有邻、间、对位,然后再取代醛基分别有4种、4种和2种共10种,故总共符合条件的同分异构体有16种;其中核磁共振氢谱为五组峰的结构简式为
,同时满足条件的同分异构体:①遇FeCl3溶液发生显色反应则含有酚羟基;②能发生银镜反应则含有醛基;③除苯环以外不再含有其他环状结构,若苯环上只有两个取代基,则为酚羟基和-CH=CHCHO或酚羟基和-C(CHO)=CH2,位置上有邻、间、对位,故有6种同分异构体; 若苯环上有三个取代基则为酚羟基、-CH=CH2、-CHO,先定酚羟基、-CH=CH2在苯环上有邻、间、对位,然后再取代醛基分别有4种、4种和2种共10种,故总共符合条件的同分异构体有16种;其中核磁共振氢谱为五组峰的结构简式为![]() ;(5)缺少的反应流程为乙醛在氢氧化钠溶液中加热反应生成
;(5)缺少的反应流程为乙醛在氢氧化钠溶液中加热反应生成![]() ,
,![]() 与氢气发生加成反应生成
与氢气发生加成反应生成![]() ,合成路线如下CH3CH2OH
,合成路线如下CH3CH2OH![]() CH3CHO
CH3CHO![]()
![]()
![]() CH3CH2CH=CH2。
CH3CH2CH=CH2。

【题目】金属铬在工业上有广泛用途,主要用于不锈钢及高温合金的生产。铬铵矾(NH4Cr(SO4)2·12H2O)法是一种以碳素铬铁(主要是由Cr、Fe、C形成的合金)为主要原料生产金属铬,并能获得副产物铁铵矾【(NH4Cr(SO4)2·12H2O)】的方法。有关流程如下:

己知部分阳离子以氢氧化物开始沉淀和完全沉淀的pH如下表(金属离子浓度为0.01mol/L):
沉淀物 | Fe(OH)2 | Fe(OH)3 | Cr(OH)3 |
开始沉淀的pH | 7.6 | 2.7 | 4.9 |
完全沉淀的pH | 9.6 | 3.7 | 6.8 |
(1)溶解碳素铬铁前需将其粉碎,其目的是____________
(2)净化和转化阶段:所得残渣的主要成分是___________,转化时需要添加定量的H2O2,其目的是__________。由溶液1获得铁铵矾晶体的操作方法为______,过滤、洗涤、干燥。
(3)将铬铵矾晶体溶于稀硫酸,而不是直接溶于水的主要原因是_________________。
(4)阳极液通入SO2的离子反应方程式______________。
(5)工业废水中含有一定量的Cr3+,也含有一定量的Mg2+、Ca2+,而除去“钙、镁”是将其转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10,当加入过量NaF使两种沉淀共存时,溶液中c(Mg2+)/c(Ca2+)=__________。
(6)某课外活动小组将铬铵矾(NH4CrSO4)·12H2O)经过一系列操作获得了Cr2(CO3)3粗品。该小组利用EDTA(乙二胺四乙酸二钠,阴离子简写为H2Y2-)测定粗品中Cr2(CO3)3的质量分数,准确称取2.00g粗品试样,溶于5.0mL稀盐酸中,依次加入5.0mLNH3·NH4Cl缓冲溶液、0.10g紫脲酸铵混合指示剂,用0.100mol/LEDTA标准溶液滴定至呈稳定颜色,平均消耗标准溶液5.00mL已知:Cr3++H2Y2-=CrY+2H+。
①滴定操作中,如果滴定前装有EDIA标准溶液的满定管尖嘴部分有气泡,而滴定结束后气泡消失,则测定结果将_____(填“偏大”、“偏小”或“不变”)。
②粗品中Cr2(CO3)3的质量分数w[Cr2(CO3)3]=____。
【题目】市场销售的某种精制食用盐包装袋上有如下说明:
产品标准 | GB5461 |
产品等级 | 一级 |
配料 | 食盐、碘酸钾、抗结剂 |
碘含量(以I计) | 20~50mg/kg |
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处)
KIO3+KI+H2SO4=K2SO4+I2+H2O,______________
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应后溶液显酸性,写出该反应的离子方程式:_____________________________。
②某同学设计回收四氯化碳的操作步骤如下,请将缺少的操作步骤补充完整。
a.将碘的四氯化碳溶液置于分液漏斗中; b.加入适量Na2SO3溶液
c.____________________ d.分离出下层液体。
(3)已知:I2+2S2O32=2I-+S4O62-。某质量检验监督局测定食用精制盐的碘含量,其步骤为:
a.准确称取12.7g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,以6.0×10-4mol·L-1的Na2S2O3标准溶液滴定,消耗20.00mL标准液。
①判断c中滴定反应恰好完全的现象是_____________________。
②根据以上实验和包装袋说明,所测精制盐的碘含量是____mg/kg。
(4)用惰性电极电解KI溶液可制备碘酸钾,则阳极反应式为_____________________。
【题目】用某废催化剂(主要成分Al2O3、K2O、少量CoO、SiO2等)来制取明矾的工艺流程如下图所示,回答下列问题:

(1)废催化剂在浸取前进行球磨的主要目的是________________________________________。
(2)浸取时Al2O3溶解的化学方程式为________________________________________;
(3)滤渣的主要成分是_________________ (填化学式)。
(4)实验测得K2CO3的加入量与KA1(SO4)2·12H2O产率及纯度关系如下表所示:
编号 | 1 | 2 | 3 | 4 |
K2CO3加入量/g | 2 | 4 | 6 | 8 |
产品质量/g | 3.3 | 5.7 | 4.6 | 4.5 |
明矾纯度/g | 99.1 | 98.2 | 91.4 | 84.9 |
当K2CO3的加入量超过4 g后,晶体的质量减少且纯度降低,其原因是________________________。