题目内容
【题目】(1)基态溴原子的核外电子排布式为________,其核外电子所占用的最高能级电子云形状为_________。
(2)尿素(H2NCONH2)分子中,原子杂化轨道类型有_____,σ键与π键数目之比为______。
(3)铍与铝元素性质相似。下列有关铍与铝的叙述正确的是_____ (填标号)。
A.都属于p区主族元素 B.电负性都比镁大
C.第一电离能都比镁大 D.氯化物的水溶液都呈酸性
(4)NH3分子中∠HNH键角为107°,而配离子[Zn(NH3)6]2+中∠HNH的键角为109.5°。配离子[Zn(NH3)6]2+中∠HNH键角变大的原因是_______。
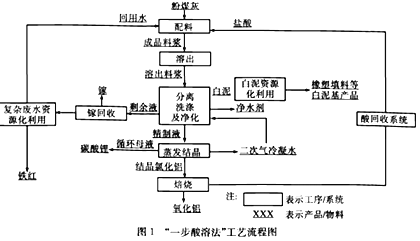
(5)氮化硼(BN)是一种性能优异、潜力巨大的新型材料,主要结构有立方氮化硼(如图1)和六方氮化硼(如图2),前者类似于金刚石,后者与石墨相似。
①晶胞中的原子坐标参数可表示晶胞内部各原子的相对位置。图1中原子坐标参数A为(0,0,0),D为(0.5,0.5,0),则E原子的坐标参数为________。
②已知六方氮化硼同层中B-N距离为acm,密度为dg/cm3,则层与层之间距离的表达式为___pm.
【答案】 [Ar]3d104s24p5 哑铃形或纺锤形 sp2、sp3 7:1 BD NH3分子中N原子的孤对电子进入Zn2+的空轨道形成配离子后,原孤对电子对NH键的成键电子对的排斥作用变为成键电子对之间的排斥,排斥作用减弱 (0.25,0.75,0.75) ![]()
【解析】(1)溴的原子的质子数为35,核外电子数为35,由核外电子排布规律可知其电子排布式为1s22s22p63s23p63d104s24p5或[Ar]3d104s24p5;其核外电子所占用的最高能级为4p能级,电子云形状为哑铃形或纺锤形;(2)由尿素分子的结构式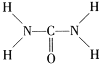 可知,尿素分子中C原子成2个C-N键、1个C=O键,没有孤对电子,杂化轨道数目为3,C原子采取sp2杂化,N原子成3个单键,含有1对孤对电子,杂化轨道数为4,N原子采取sp3杂化;分子中含有7个σ键和1个π键,σ键与π键数目之比为7:1;(3)铍与相邻主族的铝元素性质相似。A.Be属于s区,Al属于p区,选项A错误;B.电负性都比镁大,选项B正确;C.第二周期元素Mg的第一电离能比第三周期Al的大,选项C错误;D.氯化物的水溶液均发生水解,溶液显酸性,则pH<7,选项D正确。答案选BD;(4) NH3分子中N原子的孤对电子进入Zn2+的空轨道形成配离子后,原孤对电子对NH键的成键电子对的排斥作用变为成键电子对之间的排斥,排斥作用减弱,故配离子[Zn(NH3)6]2+中∠HNH键角变大;(5) ①晶胞中的原子坐标参数可表示晶胞内部各原子的相对位置。根据图中信息可知,图1中原子坐标参数A为(0,0,0),D为(0.5,0.5,0),则E原子的坐标参数为(0.25,0.75,0.75);②根据均摊法可知,晶胞中含有
可知,尿素分子中C原子成2个C-N键、1个C=O键,没有孤对电子,杂化轨道数目为3,C原子采取sp2杂化,N原子成3个单键,含有1对孤对电子,杂化轨道数为4,N原子采取sp3杂化;分子中含有7个σ键和1个π键,σ键与π键数目之比为7:1;(3)铍与相邻主族的铝元素性质相似。A.Be属于s区,Al属于p区,选项A错误;B.电负性都比镁大,选项B正确;C.第二周期元素Mg的第一电离能比第三周期Al的大,选项C错误;D.氯化物的水溶液均发生水解,溶液显酸性,则pH<7,选项D正确。答案选BD;(4) NH3分子中N原子的孤对电子进入Zn2+的空轨道形成配离子后,原孤对电子对NH键的成键电子对的排斥作用变为成键电子对之间的排斥,排斥作用减弱,故配离子[Zn(NH3)6]2+中∠HNH键角变大;(5) ①晶胞中的原子坐标参数可表示晶胞内部各原子的相对位置。根据图中信息可知,图1中原子坐标参数A为(0,0,0),D为(0.5,0.5,0),则E原子的坐标参数为(0.25,0.75,0.75);②根据均摊法可知,晶胞中含有![]() 个N原子,4个B原子,已知六方氮化硼同层中B-N距离为acm,密度为dg/cm3,V=
个N原子,4个B原子,已知六方氮化硼同层中B-N距离为acm,密度为dg/cm3,V=![]() ,则层与层之间距离的表达式为
,则层与层之间距离的表达式为![]() pm。
pm。

【题目】研究CO2的利用对促进低碳社会的构建具有重要的意义。
I.己知某些化学键的键能数据如下:
化学键 | C=O | C-O | C-H | H-H | O-H |
键能/kJ·mol-1 | a | b | c | d | e |
(1)CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H=____kJ/mol(用字母表示)。
CH3OH(g)+H2O(g) △H=____kJ/mol(用字母表示)。
II.将燃煤废气中的CO 转化为二甲醚的反应原理为:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
(2)已知在某压强下,该反应在不同温度、不同投料比时,达平衡时CO2的转化率如下图所示:

①该反应的△H_____0(填“>”或“<”)。
②700K,将4molH2和2molCO2投入2L恒容密闭容器中,反应经3min达到平衡,则CH3OCH3(g)在0~3min内的生成速率为_________。
(3)某温度下,向体积一定的密闭容器中通入CO2(g)与H2(g)发生上述反应,下列物理量不再发生变化时,能说明反应达到平衡状态的是_______。
A.二氧化碳的浓度 B.容器中的压强
C.气体的密度 D.CH3OCH3与H2O的物质的量之比
(4)某温度下,在体积可变的密闭容器中,改变起始时加入各物质的量,在不同的压强下,平衡时CH3OCH3(g)的物质的量如下表所示:
P1 | P2 | P3 | |
I.2.0molCO26.0molH2 | 0.10mol | 0.04mol | 0.02mol |
II.1.0molCH3OCH33.0molH2O | X1 | Y1 | Z1 |
①P3______P2(填“>”、“<”或“”);
②P2下,I中CH3OCH3的平衡转化率为_______。
III.在一定条件下,CO2(g)+H2(g)![]() CO(g)+H2O(g)。
CO(g)+H2O(g)。
(5)在1L密闭容器中若CO2(g)、H2(g)初始投料均为1mol,反应达平衡时CO在平衡混合气中的体积分数为25%,则该温度下该反应的平衡常数K=____。向此容器中再充入CO2(g)、H2(g)各0.5mol,则平衡_______(填“正向移动”、“逆向移动”或“不移动”)。