题目内容
17.已知过氧化钠与水反应生成氢氧化钠和氧气,其化学方程式为2Na2O2+2H2O═4NaOH+O2↑.现将7.8g Na2O2溶于100mL 0.1mol•L-1NaOH溶液中,反应完全后,加入适量水稀释至250mL,则最后所得溶液中溶质的物质的量浓度是( )| A. | 0.8mol•L-1 | B. | 0.84mol•L-1 | C. | 1.6mol•L-1 | D. | 1.05mol•L-1 |
分析 根据n=$\frac{m}{M}$计算出7.8g过氧化钠的物质的量,再根据反应2Na2O2+2H2O═4NaOH+O2↑计算出生成氢氧化钠的物质的量,然后根据n=cV计算出100mL 0.1mol•L-1NaOH溶液中含有氢氧化钠的物质的量,从而可得出反应后的溶液中含有氢氧化钠的总物质的量,最后根据c=$\frac{n}{V}$计算出最后所得溶液中溶质NaOH的物质的量浓度.
解答 解:7.8g过氧化钠的物质的量为:$\frac{7.8g}{78g/mol}$=0.1mol,
根据反应2Na2O2+2H2O═4NaOH+O2↑可知0.1mol过氧化钠完全反应生成0.2mol氢氧化钠,
100mL 0.1mol•L-1NaOH溶液中含有氢氧化钠的物质的量为:0.1mol/L×0.1L=0.01mol,
反应后的溶液中含有氢氧化钠的物质的量为:0.2mol+0.01mol=0.21mol,
最后所得溶液中溶质的物质的量浓度为:c(NaOH)=$\frac{0.21mol}{0.25L}$=0.84mol/L,
故选B.
点评 本题考查了物质的量浓度的计算,题目难度中等,明确物质的量与物质的量浓度、摩尔质量之间的关系为解答关键,注意熟练掌握物质的量浓度的概念及表达式.

练习册系列答案
相关题目
7.下列离子反应能发生的是( )
| A. | AgNO3+NaCl═AgCl↓+NaNO3 | B. | Na2CO3+Ca(OH)2═CaCO3↓+2NaOH | ||
| C. | KCl+NaOH═NaCl+KOH | D. | Na2SO4+2HCl═2NaCl+H2SO4 |
8.将0.01molCl2通入含0.03molBr-和0.03molI-的混合液中,再加CCl4振荡,则CCl4层的颜色是( )
| A. | 紫色 | B. | 橙红色 | C. | 棕色 | D. | 紫黑色 |
5.某元素原子的最外层电子排布式为ns2,该元素( )
| A. | 一定是ⅡA族元素 | |
| B. | 一定是金属元素 | |
| C. | 可能是金属元素也可能是非金属元素 | |
| D. | 不是ⅡA族元素就是副族元素 |
12.下列示意图或图示正确的是( )
| A. | 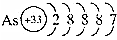 砷原子结构示意图 | B. | 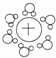 水合钠离子示意图 | ||
| C. |  乙酸分子的比例模型 | D. |  氢原子电子云示意图 |
2.下列离子方程式的书写正确的是( )
| A. | 硫酸铁与氢氧化钡溶液混合恰好完全反应:Fe3++SO42-+Ba2++3OH-═Fe(OH)3↓+BaSO4↓ | |
| B. | 利用氯酸钾和浓盐酸制气体消毒剂ClO2:2ClO3-+4H++2Cl-═2ClO2↑+Cl2↑+2H2O | |
| C. | 碳酸氢镁与足量的石灰水反应:Mg2++2HCO3-+2OH-+Ca2+═CaCO3↓+MgCO3↓+2H2O | |
| D. | 往FeI2溶液中通过量Cl2:Cl2+2Fe2+═2Cl-+2Fe3+ |
6.下列应用或者现象对应的水解方程式书写错误的是( )
| 应用或现象 | 水解方程式 | |
| A | 浓硫化钠溶液有臭味 | S2-+2H2O?H2S+2OH- |
| B | 配制FeCl3溶液时,常加入少量的盐酸 | Fe3++3H2O?Fe(OH)3+3H+ |
| C | CaCO3饱和溶液的pH约为9.3 | CO32-+H2O?HCO3-+OH- |
| D | 加热蒸干AlCl3溶液得到Al(OH)3固体 | AlCl3+3H2O?Al(OH)3+3HCl |
| A. | A | B. | B | C. | C | D. | D |