题目内容
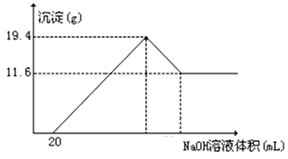
镁铝合金5.1 g溶于300mL2mol/L的HCl,在标准状况下放出气体的体积为5.6L。向反应后的溶液中加入足量氨水,产生沉淀的质量为
| A.5.1g | B.10.2g | C.13.6g | D.15.3g |
C
加入氨水后得到的沉淀是氢氧化镁和氢氧化铝。因此沉淀的质量就是合金的质量和金属阳离子结合的OH-的质量。由于金属失去电子的物质的量就是结合的OH-的物质的量,所以根据氢气是0.25mol可知,转移电子是0.5mol,则结合的OH-的物质的量是0.5mol,质量是8.5g,因此沉淀质量是5.1g+8.5g=13.6g,答案选C。

练习册系列答案
 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
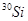 的原子的中子数为_________;
的原子的中子数为_________;