题目内容
【题目】煤作为主要的能源物质,在国民生产和生活中起重要作用,但直接排放煤燃烧产生的烟气会引起严重的环境问题,将烟气通过装有石灰石(主要成分:CaCO3)浆液的脱硫装置可以除去其中的 SO2气体,最终生成硫酸钙。硫酸钙可在如图所示的循环燃烧装置的燃料反应器中与甲烷反应,气体产物分离出水后得到几乎不含杂质的二氧化碳,从而有利于 CO2的回收利用,达到减少碳排放的目的。

请回答下列问题:
(1)煤燃烧产生的烟气直接排放在空气中,不会引发的环境问题是(______)
A. 温室效应 B. 酸雨 C. 粉层污染 D. 水体富营养化
(2)在烟气脱硫的过程中,所用的石灰石浆液在进入脱硫装置前,需通过一段时间的CO2,以增加脱硫效率;脱硫时控制浆液的pH值,此时浆液含有的Ca(HSO3)2可以快速被氧化为CaSO4。
①从分子结构看,CO2是由_____ 共价键构成的_____分子(选填:“极性”或“非极性”)。它与石灰石浆液反应的属于 _________反应。(选填“化合”、“分解”、“置换”、“复分解”),固体的CO2被称为干冰,其受热很容易_______。(填一种物理现象)
②Ca(HSO3)2从晶体类型看属于_____晶体,它溶于蒸馏水的电离方程式为______________________,它与足量氧气反应生成硫酸氢钙的化学方程式是_________________。用单线桥表示出反应物中电子转移的数目和方向:____________________。
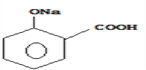
③回收的CO2与酚羟基的钠盐在一定条件下反应,生成有机物M,其化学式为C7H5O3Na,M经过稀硫酸酸化后得到一种药物中间体N,N的结构简式为:

M的结构简式为________________除苯基外,药物中间体N所含的官能团还有______________(填写“中文名称”)N在一定条件下可以经过自身缩聚形成一种高分子化合物,试写出形成高分子的化学反应:__________________。分子中无 -O-O- ,醛基与苯环直接相连的N的同分异构体共有_______种。
【答案】 D 极性 非极性 化合 升华 离子 Ca(HSO3)2 → Ca2+ + 2HSO3- 、HSO3- ![]() H+ + SO32- Ca(HSO3)2 + O2 → Ca(HSO4)2
H+ + SO32- Ca(HSO3)2 + O2 → Ca(HSO4)2 ![]()
 酚羟基、羧基
酚羟基、羧基  6 种
6 种
【解析】(1)煤燃烧的产物中有CO2、烟尘以及SO2,分别导致温室效应、粉尘污染和酸雨,没有营养元素排入水中,不会引起水体富营养化;故答案为D;
(2)①从分子结构看,CO2是由极性共价键构成的非极性分子;CO2与CaCO3反应生成易溶的Ca(HCO3)2,此反应的属于化合反应;固体的CO2被称为干冰,其熔、沸点极低,受热很容易发生升华现象;
②Ca(HSO3)2含有离子键,从晶体类型看属于离子晶体,溶于蒸馏水的电离方程式为Ca(HSO3)2 → Ca2+ + 2HSO3- 、HSO3- ![]() H+ + SO32- ,亚硫酸氢钙具有还原性,可被氧化为硫酸钙,方程式为:Ca( HSO3)2+O2=CaSO4+H2SO4;此反应为氧化还原反应,其中氧气为氧化剂,易得电子,用单线桥表示出反应物中电子转移的数目和方向为
H+ + SO32- ,亚硫酸氢钙具有还原性,可被氧化为硫酸钙,方程式为:Ca( HSO3)2+O2=CaSO4+H2SO4;此反应为氧化还原反应,其中氧气为氧化剂,易得电子,用单线桥表示出反应物中电子转移的数目和方向为![]() ;
;
③)①因为酸性羧酸>碳酸>苯酚,碳酸不与-COONa反应,则M为![]() ;
;
除苯基外,药物中间体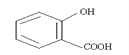 所含的官能团还有 酚羟基、羧基;
所含的官能团还有 酚羟基、羧基;
 在一定条件下可以经过自身缩聚形成一种高分子化合物,形成高分子的化学反应为
在一定条件下可以经过自身缩聚形成一种高分子化合物,形成高分子的化学反应为 ;
;
N对应的同分异构体中含有2个-OH和1个-CHO,-CHO可在如图中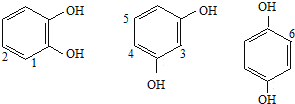 6种位置。
6种位置。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】(1)已知H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJmol-1。若向三份等体积、等物质的量浓度的NaOH溶液中分别加入醋酸、浓硫酸、稀硝酸至恰好完全反应,并将上述过程中放出的热量分别记为Q1kJ、Q2kJ、Q3kJ。则三者的由小到大关系是________(用Q1、Q2、Q3表示)。
(2)如图所示A为泡沫塑料板,上面有两个小孔,分别插入温度计和环形玻璃搅拌棒,两个小孔不能开得过大,其目的是_____________________; 若实验中不加盖泡沫塑料板,则求得的中和热数值______(填偏大、偏小、无影响)
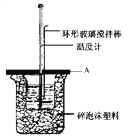
(3)实验室用50mL 0.50molL-1盐酸、50mL 0.55molL-1 NaOH溶液利用上图装置,进行测定中和热的实验。假设盐酸和氢氧化钠溶液的密度都是1 g/cm3,又知中和后生成溶液的比热容c=4.18 J/(g℃)。为了计算中和热,实验时还需测量的数据有(填序号)________。
A.反应前盐酸的温度 B.反应前盐酸的质量
C.反应前氢氧化钠溶液的温度 D.反应前氢氧化钠溶液的质量
E.反应后混合溶液的最高温度 F.反应后混合溶液的质量
(4)某学生实验记录数据如下:
实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.4 |
2 | 20.2 | 20.4 | 23.6 |
3 | 20.5 | 20.6 | 23.8 |
依据该学生的实验数据计算,该实验测得的中和热ΔH为________。(保留三位有效数字)