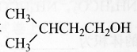题目内容
【题目】CH4既是一种重要的能源,也是一种重要的化工原料。
(1)以CH4为燃料可设计成结构简单、能量转化率高、对环境无污染的燃料电池,其工作原理如图甲所示,则通入a气体的电极反应式为_____________,通入b气体的电极反应式为 _____________________。(质子交换膜只允许H+通过)
(2)在一定温度和催化剂作用下,CH4与CO2可直接转化成乙酸,这是实现“减排”的一种研究方向。
①在不同温度下,催化剂的催化效率与乙酸的生成速率如图乙所示,则该反应的最佳温度应控制在 _________左右。
②该反应催化剂的有效成分为偏铝酸亚铜(CuAlO2,难溶物)。将CuAlO2溶解在稀硝酸中生成两种盐并放出NO气体,其离子方程式为 _______________________________。
(3)CH4还原法是处理NOx气体的一种方法。已知一定条件下CH4与NOx反应转化为N2和CO2,若标准状况下11.2 L CH4可处理22.4 L NOx,则x值为________。

【答案】 CH4-8e- + 4H2O = 2CO2 + 8 H+ O2 + 4 e- + 4 H+ = 2 H2O 250℃ 3 CuAlO2 + 16 H+ + NO3- = NO↑+ 3 Al3+ + 3Cu2+ + 8H2O 2
【解析】(1)由图可知,通入气体a的一端发生氧化反应,故应通入甲烷,该极为负极,电极反应式为CH4-8e- + 4H2O=2CO2 + 8H+;通入b为氧气,获得电子,酸性条件下生成水,正极电极反应式为:O2+4e-+4H+ =2H2O;(2)①250℃时乙酸反应速率最大、催化活性,故选择250℃;②CuAlO2溶解在稀硝酸中生成两种盐并放出NO气体,生成的盐为硝酸铝、硝酸铜,反应还有水生成,反应离子方程式为:3CuAlO2+16H++NO3- =NO↑+3Al3++3Cu2+ + 8H2O;(3)根据电子转移守恒,则:11.2L×[4-(-4)]=22.4L×2x,解得x=2。