题目内容
50℃时,下列各溶液中,离子的物质的量浓度关系正确的是
| A.pH=4的醋酸中:c(H+)= 4.0molL-1 |
| B.饱和小苏打溶液中:c(Na+)= c(HCO3-) |
| C.饱和食盐水中:c(Na+)+ c(H+)= c(Cl-)+c(OH-) |
| D.pH=12的纯碱溶液中:c(OH-)= 1.0×10-2 molL-1 |
C
解析试题分析:A、pH=4的醋酸中:c(H+)=10-4molL-1,错误;B、饱和小苏打溶液中,因为HCO3?发生水解反应,所以c(Na+)> c(HCO3-),错误;C、根据电荷守恒,饱和食盐水中离子浓度存在:c(Na+)+ c(H+)= c(Cl-)+c(OH-),正确;D、因为温度为50℃,离子积常数Kw大于1.0×10-14,所以c(OH-)> 1.0×10-2 molL-1,错误。
考点:本题考查离子浓度与pH的计算、离子浓度比较。

练习册系列答案
相关题目
25℃时,某溶液中只含有Na+、H+、OH-、A-四种离子。下列说法正确的是 ( )
| A.对于该溶液一定存在:pH≥7 |
| B.若c(OH-)>c(H+),则溶液中不可能存在:c(Na+)>c(OH-)>c(A-)>c(H+) |
| C.若溶液中c(A-)= c(Na+),则溶液一定呈中性 |
| D.若溶质为NaA,则溶液中一定存在:c(Na+)>c(A-)>c(OH-)>c(H+) |
常温下,浓度均为0.1 mol/L 的下列四种盐溶液,其pH测定如下表所示:
| 序号 | ① | ② | ③ | ④ |
| 溶液 | CH3COONa | NaHCO3 | Na2CO3 | NaClO |
| pH | 8.8 | 9.7 | 11.6 | 10.3 |
下列说法正确的是
A.四种溶液中,水的电离程度①>②>④>③
B.Na2CO3和NaHCO3溶液中,粒子种类相同
C.将等浓度的CH3COOH和HClO溶液比较,pH小的是HClO
D.Na2CO3溶液中, c(Na+) = c(CO32-)+c(HCO3-)+c(H2CO3)
如图所示用一定浓度的NaOH溶液Y滴定10 mL一定物质的量浓度的盐酸X,依据图示推出X和Y的物质的量浓度是下列各组中的( )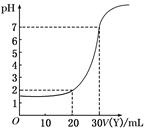
| | A | B | C | D |
| X物质的量浓度/mol·L-1 | 0.12 | 0.04 | 0.03 | 0.09 |
| Y物质的量浓度/mol·L-1 | 0.04 | 0.12 | 0.09 | 0.03 |
下列有关AgCl沉淀的溶解平衡的说法中,正确的是( )
| A.AgCl沉淀生成和溶解不断进行,但速率相等 |
| B.AgCl难溶于水,溶液中没有Ag+和Cl- |
| C.升高温度,AgCl的溶解度减小 |
| D.向AgCl沉淀的溶解平衡体系中加入NaCl固体,AgCl的溶解度不变 |
已知:25 ℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp(MgF2)=7.42×10-11。下列说法正确的是( )
| A.25 ℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大 |
| B.25 ℃时,在Mg(OH)2的悬浊液加入少量的NH4Cl固体,c(Mg2+)增大 |
| C.25 ℃时,Mg(OH)2固体在20 mL 0.01 mol·L-1氨水中的Ksp比在20 mL 0.01 mol·L-1 NH4Cl溶液中的Ksp小 |
| D.25 ℃时,在Mg(OH)2的悬浊液加入NaF溶液后,Mg(OH)2不可能转化成为MgF2 |
用0.1 mol·L-1 NaOH溶液滴定0.1 mol·L-1盐酸,如达到滴定终点时不慎多加了1滴NaOH溶液(1滴溶液的体积约为0.05 mL),继续加水至50 mL,所得溶液的pH是( )
| A.4 | B.7.2 | C.10 | D.11.3 |
以甲基橙为指示剂,用0.10 mol·L-1的盐酸滴定0.10 mol·L-1的氨水,
滴定过程中不可能出现的结果是( )
| A.c(NH4+)>c(Cl-),c(OH-)>c(H+) |
| B.c(NH4+)=c(Cl-),c(OH-)=c(H+) |
| C.c(Cl-)>c(NH4+),c(OH-)>c(H+) |
| D.c(Cl-)>c(NH4+),c(H+)>c(OH-) |