题目内容
设NA为阿伏加德罗常数的值,下列叙述中正确的是
| A.1mol丙烷含有的非极性共价键数目为NA |
| B.常温下,1.8 g H2O含有的电子数为NA |
| C.25℃时,pH=13的 Ba(OH)2溶液中含有的OH-数目为0.1 NA |
| D.2.24L氯气与过量的氢氧化钠溶液完全反应转移的电子数为0.1NA |
B
解析试题分析:A、丙烷中含有的非极性键为碳碳键,1个丙烷分子含有2个碳碳单键,所以1mol丙烷含有的非极性共价键数目为2NA,错误;B、1.8 g H2O物质的量为:1.8g÷18g/mol=0.1mol,所以含有的电子数为NA,正确;C、没有指明溶液的体积,所以无法求算OH?数目,错误;D、没有指明温度和压强,2.24L氯气的物质的量无法换算,错误。
考点:本题考查阿伏伽德罗常数的应用。

练习册系列答案
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案
相关题目
设阿伏加德罗常数的值为,则下列说法正确的是 ( )
A.标准状况下,22.4 L乙烯含有的共用电子对数为2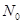 |
B.常温下,含有1 mol NaHSO4溶液中的阳离子数为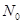 |
C.通常状况下,1 mol NO和0.5 molO2在密闭容器中混合,生成NO2分子数为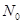 |
D.制取漂白粉时,标准状况下22.4 LCl2参加反应,转移电子数为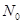 |
用98%的浓硫酸(密度1.84g · mL-1)配制100mL 1mol·L-1的稀硫酸。现给出下列配制中可能用到的仪器:①100 mL量筒;②10 mL量筒;③50 mL烧杯;④托盘天平;⑤100 mL容量瓶;⑥胶头滴管;⑦玻璃棒。按使用仪器的先后顺序作出的下列排列中正确的是
| A.④③⑥⑦⑤⑥ | B.②⑥③⑦⑤⑥ | C.①③⑤⑦⑤⑥ | D.②③⑥⑦⑤⑥ |
下列化学用语使用不正确的是( )。
A.Na+的结构示意图为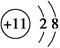 |
| B.明矾的化学式为KAl(SO4)2·12H2O |
| C.聚乙烯的结构简式为CH2===CH2 |
| D.高氯酸(HClO4)中氯元素的化合价为+7 |
下列有关化学用语的表示正确的是( )
A.S2-的结构示意图为: |
| B.质子数为53、中子数为78的碘原子:13153I |
C.F-的结构示意图: |
| D.由含有2个中子的氢原子与10个中子的氧原子形成的水分子的化学式可表示为:21H2188O |
一定温度下,硫酸铜受热分解生成CuO、SO2、SO3和O2。已知:SO2、SO3都能被碱石灰和氢氧化钠溶液吸收。利用如图所示装置加热硫酸铜粉末直至完全分解。若硫酸铜粉末质量为10.0 g,完全分解后,各装置的质量变化关系如表所示。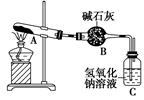
| 装置 | A(试管+粉末) | B | C |
| 反应前 | 42.0 g | 75.0 g | 140.0 g |
| 反应后 | 37.0 g | 79.5 g | 140.0 g |
请通过计算,推断出该实验条件下硫酸铜分解的化学方程式是( )
A.4CuSO4
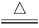 4CuO+2SO3↑+2SO2↑+O2↑
4CuO+2SO3↑+2SO2↑+O2↑B.3CuSO4
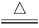 3CuO+SO3↑+2SO2↑+O2↑
3CuO+SO3↑+2SO2↑+O2↑C.5CuSO4
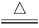 5CuO+SO3↑+4SO2↑+2O2↑
5CuO+SO3↑+4SO2↑+2O2↑D.6CuSO4
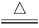 6CuO+4SO3↑+2SO2↑+O2↑
6CuO+4SO3↑+2SO2↑+O2↑ 下列有关化学用语表示正确的是( )。
| A.二氧化硅的分子式:SiO2 |
| B.聚乙烯的结构简式:?CH2CH2? |
| C.高氯酸钠(NaClO4)中Cl元素的化合价:+6 |
| D.Mg5(Si4O10)2(OH)2·4H2O的氧化物形式:5MgO·8SiO2·5H2O |
用NA表示阿伏加德罗常数的值。下列叙述中正确的是 ( )。
| A.7.8 g Na2O2中含有的阴离子数为0.2NA |
| B.铜与浓硫酸反应中,当转移的电子数为0.2NA时,生成的SO2为2.24 L |
| C.1 mol·L-1的NH4Cl溶液中的NH4+的数目小于NA |
| D.由NO2、O2组成的混合物中共有NA个分子,其中的氧原子数目为2NA |
设NA为阿伏加德罗常数的数值,下列叙述错误的是( )。
| A.标准状况下,11.2 L氢气中含有1 mol质子 |
| B.12 g金刚石含有的共价键数为4NA |
| C.46 g NO2和N2O4混合气体中含有原子总数为3NA |
| D.1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |