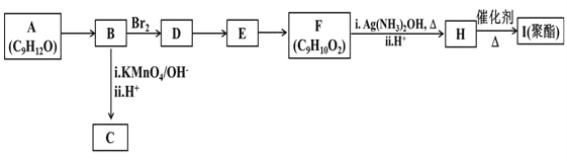
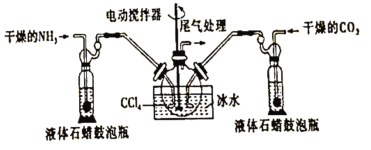
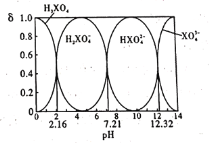
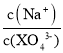题目内容
【题目】下列离子方程式与所述事实相符且正确的是
A.氯化铝溶液中加入过量氨水:Al3++4NH3·H2O=AlO+4NH+2H2O
B.Ca(HCO3)2溶液中加入过量NaOH溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
C.水玻璃中通入少量的二氧化碳:Na2SiO3+CO2+H2O=2Na++CO32-+H2SiO3↓
D.少量SO2通入漂白粉溶液中:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
【答案】B
【解析】
A.氨水是弱碱,铝盐和弱碱反应只能得到![]() 而不能得到
而不能得到![]() ,属于事实性错误,A项错误;
,属于事实性错误,A项错误;
B.![]() 可以和
可以和![]() 反应得到
反应得到![]() ,
,![]() 可以和
可以和![]() 得到
得到![]() ,B项正确;
,B项正确;
C.硅酸钠是强电解质,应该拆成离子的形式,C项错误;
D.次氯酸具有氧化性,![]() 具有还原性,二者发生氧化还原反应
具有还原性,二者发生氧化还原反应![]() 应被氧化为+6价的
应被氧化为+6价的![]() ,产物是硫酸钙,D项错误;
,产物是硫酸钙,D项错误;
答案选B。

练习册系列答案
 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
【题目】由下列实验及现象,推出的相应结论正确的是
实验 | 现象 | 结论 |
A.用铂丝蘸取某金属的盐溶液, 在酒精灯火焰上灼烧 | 火焰呈黄色 | 此盐溶液中含有 Na+,不含 K+ |
B.向饱和NaHCO3溶液中加入足量氯水 | 有无色气体产生 | 氯水中含HClO |
C.将足量SO2气体通入石蕊试液中 | 石蕊试液变红色 | SO2水溶液显酸性 |
D.向酸性KMnO4溶液中通入SO2 | 溶液紫色褪去 | SO2具有漂白性 |
A.AB.BC.CD.D