题目内容
【题目】已知某温度下水的离子积常数为KW,该温度下,将浓度为a mol·L-1的一元酸HA与b mol·L-1的一元碱BOH等体积混合,可判定该溶液呈中性的依据是
A. a=b B. 混合溶液中,c(H+)+c(B+)=c(OH-)+c(A-)
C. 混合溶液的pH=7 D. 混合溶液中,c(H+) =![]() mol·L-1
mol·L-1
【答案】D
【解析】
A、若a=b且HA和BOH分别是强酸和强碱或分别是弱酸、弱碱且它们的电离常数相同,所得溶液呈中性,选项A错误;B、常温下,pH=7的溶液呈中性,选项B错误;C、无论溶液呈酸性、碱性或中性,都有电荷守恒c(H+)+ c(B+)= c(OH-)+ c(A-),选项C错误;D、c(H+)·c(OH-)=Kw,所以c(H+)=时c(H+)=c(OH-),溶液呈中性,选项D正确。答案选D。

练习册系列答案
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目
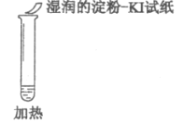
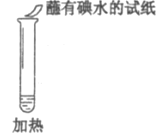
【题目】某同学向SO2和Cl2的混合气体中加入品红溶液,振荡,溶液褪色,将此无色溶液分成三份,依次进行实验,实验操作和实验现象记录如下:
序号 | ① | ② | ③ |
实验操作 |
|
|
|
实验现象 | 溶液不变红,试纸不变蓝 | 溶液不变红,试纸褪色 | 生成白色沉淀 |
下列实验分析中,不正确的是
A.①说明Cl2被完全消耗
B.②中试纸褪色的原因是:SO2+I2+2H2O=H2SO4+2HI
C.③中若将BaCl2溶液换成Ba(NO3)2溶液,也能说明SO2被Cl2氧化为SO42-
D.在实验②中加热后溶液不变红,说明溶液中品红已被氧化