题目内容
【题目】(1)在25℃、101kPa下,16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则表示甲醇燃烧热的热化学方程式为_______________________________.
(2)已知:①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) △H1=-870.3kJ/mol;
②C(s)+O2(g)=CO2(g) △H2=-393.5kJ/mol
③H2(g)+1/2O2(g)=H2O(l) △H3=-285.8kJ/mol,
则2C(s)+2H2(g)+O2(g)= CH3COOH(l)的反应热是______________
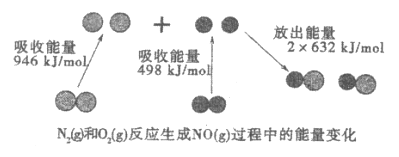
(3)如图是N2和H2反应生成2mol NH3过程中能量变化示意图,
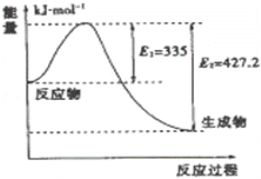
①请计算每生成1mol NH3放出热量为:________,逆反应所需的活化能为__________________ kJ/mol。
②若起始时向容器内放入1mol N2和3mol H2,达平衡后N2的转化率为20%,则反应放出的热量为Q1 kJ,则Q1的数值为__________________;
(4)用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
①如用醋酸代替盐酸进行实验,所测中和热的数值将________(填“偏大”“偏小”或“无影响”,下同);
②如用70mL0.50mol/L盐酸进行实验,所测中和热数值将__________。
【答案】CH3OH(l) +![]() O2(g) =CO2(g)+2H2O(g) △H=-352kJ/mol-488.3kJ/mol46.1kJ213.618.44偏小无影响
O2(g) =CO2(g)+2H2O(g) △H=-352kJ/mol-488.3kJ/mol46.1kJ213.618.44偏小无影响
【解析】
(1)16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,32g甲醇即1mol,燃烧生成二氧化碳和液态水放热704kJ,标注物质聚集状态和对应焓变写出热化学方程式为:CH3OH(l)+![]() O2(g)═CO2(g)+2H2O (l)△H=-704kJ/mol;
O2(g)═CO2(g)+2H2O (l)△H=-704kJ/mol;
(2)已知:①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) △H1=-870.3kJ/mol;
②C(s)+O2(g)=CO2(g) △H2=-393.5kJ/mol
③H2(g)+1/2O2(g)=H2O(l) △H3=-285.8kJ/mol,
根据盖斯定律,由②![]() 2+③
2+③![]() 2-①得反应2C(s)+2H2(g)+O2(g)= CH3COOH(l) △H=2△H2+2△H3-△H1=-393.5kJ/mol
2-①得反应2C(s)+2H2(g)+O2(g)= CH3COOH(l) △H=2△H2+2△H3-△H1=-393.5kJ/mol![]() 2-285.8kJ/mol
2-285.8kJ/mol![]() 2-(-870.3kJ/mol)=-488.3kJ/mol,则反应热是-488.3kJ/mol;
2-(-870.3kJ/mol)=-488.3kJ/mol,则反应热是-488.3kJ/mol;
(3)①该反应的焓变△H=E1-E2=335kJ/mol-427.2kJ/mol=-92.2kJ/mol,所以每生成1molNH3放出热量为46.1kJ;逆反应所需的活化能为![]() E2=
E2=![]() 427.2kJ/mol=213.6kJ/mol;
427.2kJ/mol=213.6kJ/mol;
②N2(g)+3H2(g)=2NH3(g)△H=-92.2kJ/mol
1 3 0
0.2 0.6 0.4
生成0.4mol氨气放热=![]() ×92.2kJ=18.44kJ;
×92.2kJ=18.44kJ;
(4)①醋酸为弱酸,电离过程为吸热过程,所以醋酸(CH3COOH)代替HCl溶液反应,反应放出的热量小于57.3kJ;所测中和热的数值将偏小;
②反应放出的热量和所用酸以及碱的量的多少有关,如用70mL0.50mol/L盐酸进行实验,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,所以用70mL0.50mol/L盐酸进行实验,进行上述实验,测得中和热数值相等,故无影响。