题目内容
【题目】NA为阿伏加德罗常数的值,下列说法中正确的是
A.1.68gFe和足量水蒸气反应,转移的电子数目为0.09NA
B.由31H和168O组成的超重水11g,其中所含的中子数为6NA
C.1L1mol·L-1的NaClO溶液中含有ClO-的数目为NA
D.1mol白磷(P4)分子中所含共价键数为4NA
【答案】B
【解析】
试题分析:A.1.68g Fe的物质的量为:![]() =0.3mol,0.3molFe与水蒸气加热反应生成0.1mol四氧化三铁,反应转移电子的物质的量为:0.1mol×3×(
=0.3mol,0.3molFe与水蒸气加热反应生成0.1mol四氧化三铁,反应转移电子的物质的量为:0.1mol×3×(![]() -0)=0.8mol,转移电子的数目为0.08NA,故A错误;B.11g31H和168O组成的超重水31H2168O的物质的量为:
-0)=0.8mol,转移电子的数目为0.08NA,故A错误;B.11g31H和168O组成的超重水31H2168O的物质的量为:![]() =0.5mol,0.5mol超重水中含有中子的物质的量为:0.5mol×(2×2+8)=6mol,含有的中子数目为6NA,故B正确;C、ClO-是弱酸根,在溶液中会水解,故个数小于NA个,故C错误;D、白磷中含6条P-P键来分析,故1mol白磷中含6NA条共价键,故D错误;故选B。
=0.5mol,0.5mol超重水中含有中子的物质的量为:0.5mol×(2×2+8)=6mol,含有的中子数目为6NA,故B正确;C、ClO-是弱酸根,在溶液中会水解,故个数小于NA个,故C错误;D、白磷中含6条P-P键来分析,故1mol白磷中含6NA条共价键,故D错误;故选B。

 阅读快车系列答案
阅读快车系列答案【题目】如图所示装置中,可观察到电流表指针偏转,M棒变粗,N棒变细.下表所列M、N、P物质中,可以组合成该装置的是( )
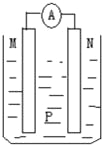
选 项 | M | N | P |
A | 锌 | 铜 | 稀硫酸 |
B | 铜 | 铁 | 稀盐酸 |
C | 银 | 锌 | 硝酸银溶液 |
D | 锌 | 铁 | 硝酸铁溶液 |
A.A B.B C.C D.D
【题目】某工厂的废气中含有CO、SO2、NO等有毒气体,为了更有效地治理该废气,某研究小组分别设计了如下两个方案:
方案(1):治理含CO、SO2的烟道气,以Fe2O3作催化剂,将CO、SO2在380℃时转化为S和一种无毒气体。
已知:ⅰ.硫的熔点112.8℃,沸点444.6℃;
ⅱ.反应每得到1mol硫,放出270kJ的热量。
①写出该治理烟道气反应的热化学方程式: 。
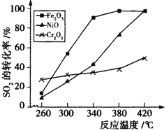
②其他条件相同,催化剂不同时,上述反应中SO2的转化率随反应温度的变化如下图。不考虑催化剂价格因素,生产中选Fe2O3作催化剂的主要原因是 。
方案(2):用活性炭还原法处理氮氧化物,有关反应为:C(s)+2NO(g) ![]() N2(g)+CO2(g)。向某容积为2L 的密闭容器中加入NO和足量的活性炭(固体试样体积忽略不计),恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g)。向某容积为2L 的密闭容器中加入NO和足量的活性炭(固体试样体积忽略不计),恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
时间/min 浓度/(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.32 | 0.32 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.34 | 0.34 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.17 | 0.17 |
①10min~20min以v(CO2)表示的反应速率为 。
②根据表中数据,T1℃时该反应的平衡常数为 (保留两位有效数字)。
③下列各项能作为判断该反应达到平衡状态标志的是 (填序号字母)。
A.容器内压强保持不变
B.2v正(NO)=v逆(N2)
C.容器内CO2的体积分数不变
D.混合气体的密度保持不变
④30min时改变某一条件,反应重新达到平衡,则改变的条件可能是 ;
⑤一定温度下,随着NO的起始浓度增大,NO的平衡转化率 (填“增大”、“减小”或“不变”)
⑥50min时,保持其他条件不变,往容器中再充入0.32 mol NO和0.34mol CO2,平衡将向 方向移动。

