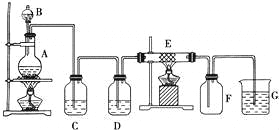
��Ŀ����
����Ŀ����úת��Ϊˮú������Ҫ��ѧ��ӦΪC��s��+H2O��g��![]() CO��g��+H2��g����
CO��g��+H2��g����
C��s����CO��g����H2��g����ȫȼ�յ��Ȼ�ѧ����ʽΪ��
C��s��+O2��g���TCO2��g������H=��393.5kJmol��1
H2��g��+![]() O2��g���TH2O��g������H=��242.0kJmol��1
O2��g���TH2O��g������H=��242.0kJmol��1
CO��g��+![]() O2��g���TCO2��g������H=��283.0kJmol��1
O2��g���TCO2��g������H=��283.0kJmol��1
��ش𣺣�1��������������д��C��s����ˮ������Ӧ���Ȼ�ѧ��Ӧ����ʽ�� ��
��2���ȽϷ�Ӧ�����ݿ�֪��1mol CO��g����1mol H2��g����ȫȼ�շų�������֮�ͱ�1mol C��s����ȫȼ�շų��������࣮��ͬѧ�ݴ���Ϊ��úת��Ϊˮú������ʹúȼ�շų����������������ͬѧ���ݸ�˹������������ѭ��ͼ�����ݴ���Ϊ��úת��Ϊˮú����ȼ�շų���������úֱ��ȼ�շų���������ȡ�����������ס�����ͬѧ�۵���ȷ���� ����ס����ҡ������жϵ������� ��

���𰸡���1��C��s��+H2O��g��=CO��g��+H2��g����H=+131.5kJ/mol��
��2���ң���ͬѧ������úת��Ϊˮú��Ҫ����������
��������
�����������1�����ݸ�˹���ɣ���C��s��+O2��g��=CO2��g����H=��393.5 kJ/mol��
��CO��g��+![]() O2��g��=CO2��g����H=��283.0 kJ/mol��
O2��g��=CO2��g����H=��283.0 kJ/mol��
��CO��g��+![]() O2��g��=CO2��g����H=��283.0 kJ/mol��
O2��g��=CO2��g����H=��283.0 kJ/mol��
���ݸ�˹���ɣ��٩��ک��۵ã�
��2�����ݸ�˹���ɣ���ѧ��Ӧ������һ����ɻ��Ƿּ�����ɣ��䷴Ӧ������ͬ�ģ�Ҳ����˵����ѧ��Ӧ�ķ�Ӧ��ֻ�뷴Ӧ��ʼ̬����̬�йأ��뷴Ӧ;���أ������һ����Ӧ���Էּ������У��������Ӧ�ķ�Ӧ��֮����÷�Ӧһ�����ʱ�ķ�Ӧ����ͬ������úת��Ϊˮú��Ҫ����������
�⣺��1����C��s��+O2��g��=CO2��g����H=��393.5 kJ/mol��
��CO��g��+![]() O2��g��=CO2��g����H=��283.0 kJ/mol��
O2��g��=CO2��g����H=��283.0 kJ/mol��
��CO��g��+![]() O2��g��=CO2��g����H=��283.0 kJ/mol��
O2��g��=CO2��g����H=��283.0 kJ/mol��
���ݸ�˹���ɣ��٩��ک��۵ã�C��s��+H2O��g��=CO��g��+H2��g����H=+131.5kJ/mol��
�ʴ�Ϊ��C��s��+H2O��g��=CO��g��+H2��g����H=+131.5kJ/mol��
��2����ѧ��Ӧ������һ����ɻ��Ƿּ�����ɣ��䷴Ӧ������ͬ�ģ�Ҳ����˵����ѧ��Ӧ�ķ�Ӧ��ֻ�뷴Ӧ��ʼ̬����̬�йأ��뷴Ӧ;���أ������һ����Ӧ���Էּ������У��������Ӧ�ķ�Ӧ��֮����÷�Ӧһ�����ʱ�ķ�Ӧ����ͬ��úת��Ϊˮú��Ҫ����������
�ʴ�Ϊ���ң���ͬѧ������úת��Ϊˮú��Ҫ����������

 ͬ����ϰ���ϴ�ѧ������ϵ�д�
ͬ����ϰ���ϴ�ѧ������ϵ�д� ͬ����ϰ����ʦ����ѧ������ϵ�д�
ͬ����ϰ����ʦ����ѧ������ϵ�д�