题目内容
【题目】如图所示,A、F为石墨电极,B、E为铁片电极.按要求回答下列问题. 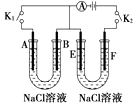
(1)打开K2 , 合并K1 . B为极,A的电极反应为 .
(2)打开K1 , 合并K2 . E为极,F极的电极反应为 , 检验F极产生气体的方法是 .
(3)若往U型管中滴加酚酞,进行(1)(2)操作时,A、B、E、F电极周围能变红的是 , 原因是 .
【答案】
(1)负; O2+4e﹣+2H2O═4OH﹣
(2)阴;2Cl﹣﹣2e﹣═Cl2↑;用湿润的淀粉﹣KI试纸检验,试纸变蓝则说明是氯气
(3)AE; A极上O2放电产生OH﹣,E极上水放电产生H2和OH﹣,均导致电极区域呈碱性
【解析】解:(1)当打开K2,闭合K1时,铁片、石墨和NaCl溶液构成原电池,负极为铁,电极反应式为:Fe﹣2e﹣═Fe2+,正极为石墨,正极的电极反应式为:O2+4e﹣+2H2O═4OH﹣,由于Fe2++2OH﹣═Fe(OH)2↓,4Fe(OH)2+O2+2H2O═4Fe(OH)3,所以可观察到的现象是:溶液中产生白色沉淀,然后变为灰绿色,最终变为红褐色,
所以答案是:负;O2+4e﹣+2H2O═4OH﹣;(2)当打开K1,闭合K2时,铁片、石墨和NaCl溶液构成电解池,阴极为铁,电极反应式为:2H++2e﹣═H2↑,阳极为石墨,电极反应式为:2Cl﹣﹣2e﹣═Cl2↑,检验Cl2的方法是:用湿润的淀粉﹣KI试纸检验,试纸变蓝则说明是氯气,
所以答案是:阴;2Cl﹣﹣2e﹣═Cl2↑;用湿润的淀粉﹣KI试纸检验,试纸变蓝则说明是氯气;(3)由于A极O2得到电子产生OH﹣,E极上水放电产生H2和OH﹣,均导致电极区域呈碱性,所以A、E电极周围遇酚酞变红,
所以答案是:AE;A极上O2放电产生OH﹣,E极上水放电产生H2和OH﹣,均导致电极区域呈碱性.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
(实验原理)2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
(实验内容及记录)
实验编号 | 实验温度 | 试管中所加试剂及其用量/mL | 溶液褪至无色所需时间/min | |||
0.6mol/L H2C2O4溶液 | H2O | 3mol/L 稀H2SO4溶液 | 0.05mol/L KMnO4溶液 | |||
① | 25 | 3.0 | V1 | 2.0 | 3.0 | 1.5 |
② | 25 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
③ | 50 | 2.0 | V2 | 2.0 | 3.0 | 1.0 |
(1)请完成此实验设计,其中:V1=________,V2=__________。
(2)实验①、②探究的是_____________对化学反应速率的影响,根据上表中的实验数据,可以得到的结论是______________________________________。
(3)探究温度对化学反应速率的影响,应选择________________(填实验编号)。
(4)利用实验1中的数据,计算用KMnO4表示的化学反应速率为__________。
(5)该小组同学根据经验绘制了n(Mn2+)随时间变化的趋势如图1所示,但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的实际趋势如图2所示。
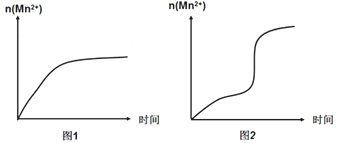
该小组同学根据图2所示信息提出了新的假设,并设计以下实验方案继续进行实验探究。
实验编号 | 实验温度/℃ | 试管中所加试剂及其用量 | 再向试管中加入某种固体 | 溶液褪至无色所需时间/min | |||
0.6mol/L H2C2O4溶液 | H2O | 3mol/L 稀H2SO4溶液 | 0.05mol/L KMnO4溶液 | ||||
④ | 25 | 2.0 | 3.0 | 2.0 | 3.0 | MnSO4 | t |
①该小组同学提出的假设是__________________________________________。
②若该小组同学提出的假设成立,应观察到_____________________________现象。

