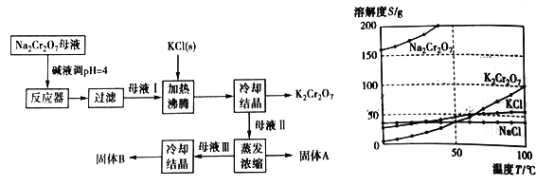
题目内容
【题目】某单质A经如下图所示的过程,请回答下列问题:
![]()
(1)若A为淡黄色固体,B是有刺激性气味的无色气体。
①A、D的化学式分别为:A__________ D__________
②工业生产中大量排放的B气体被雨水吸收后形成___________而污染环境。
③写出B→C反应的化学方程式:__________________________________________
(2)若C为淡黄色固体。
①C的电子式为___________,C中阴阳离子数目比为_________
②写出C→D反应的离子方程式:___________________________________________
【答案】 S H2SO4 酸雨 2SO2+O2![]() 2SO3
2SO3 ![]() 1:2 2Na2O2+2H2O=4Na++4OH-+O2↑
1:2 2Na2O2+2H2O=4Na++4OH-+O2↑
【解析】(1)若A为淡黄色固体,B是有刺激性气味的无色气体,则A是单质硫,B是二氧化硫,据此解答。
(2)若C为淡黄色固体,B与氧气反应生成,因此C是过氧化钠,据此解答。
(1)若A为淡黄色固体,B是有刺激性气味的无色气体,根据转化关系图可判断A是S,B是SO2,C是SO3,D是H2SO4。则
①根据以上分析可知A、D的化学式分别为S、H2SO4;
②SO2溶于水生成亚硫酸,亚硫酸易被氧化为强酸硫酸从而形成酸雨而污染环境。
③B→C反应是二氧化硫的催化氧化,反应的化学方程式为2SO2+O2![]() 2SO3。
2SO3。
(2)若C为淡黄色固体,B与氧气反应生成,因此C是过氧化钠,所以A是钠,B是氧化钠,D是氢氧化钠。则
①过氧化钠含有离子键和极性键,电子式为![]() ,根据过氧化钠的电子式可判断C中阴阳离子数目比为1:2;
,根据过氧化钠的电子式可判断C中阴阳离子数目比为1:2;
②C→D反应是过氧化钠与水反应生成氢氧化钠和氧气,反应的离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑。