题目内容
6.下列图示实验操作,能达到目的是( )| A. |  检验K+的存在 检验K+的存在 | B. | 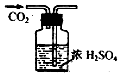 干燥CO2 | C. |  分离酒精与水 分离酒精与水 | D. |  蒸发食盐水 |
分析 A.观察K的焰色反应需要透过蓝色的钴玻璃;
B.干燥时导管长进短出;
C.蒸馏时温度计测定馏分的温度、且冷却水下进上出;
D.蒸发需要玻璃棒不断搅拌.
解答 解:A.观察K的焰色反应需要透过蓝色的钴玻璃,观察是否出现紫色可确定是否K+的存在,故A正确;
B.干燥时导管长进短出,图中气体的进入方向不合理,故B错误;
C.蒸馏时温度计测定馏分的温度、且冷却水下进上出,则图中温度计的水银球应在支管口处、冷却水方向不合理,故C错误;
D.蒸发需要玻璃棒不断搅拌,防止局部温度过高,图中缺少玻璃棒,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,把握焰色反应、混合物分离提纯、实验操作为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5.常温下,下列有关叙述正确的是( )
| A. | 在NaHA溶液中一定有:c (Na+)=c (H2A)+c (HA-)+c (A2-) | |
| B. | 能用来精确计算稀NaOH溶液中c (OH-):c (OH-)=c (NaOH)+$\frac{{K}_{W}}{c({H}^{+})}$ | |
| C. | 已知酸性:HF>CH3COOH,pH相等的NaF与CH3COOK溶液中:[c (Na+)-c (F-)]<[c (K+)-c (CH3COO-)] | |
| D. | 常温下,向5mL含有KCl和KI各为0.01mol/L的溶液中加入8mL 0.01mol/LAgNO3溶液,此时溶液中溶质的离子浓度大小关系:c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-) |
6.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 25℃时,pH=l的盐酸溶液中,由水电离出的H+个数为10-13NA | |
| B. | 电解精炼铜时转移了NA个电子,阳极溶解 32 g铜 | |
| C. | 12.4 g白磷(P4)晶体中含有的P-P键数是0.4NA | |
| D. | 1.8g18O2分子与1.8g18O3分子中含有的氧原子数均为0.1NA |
14.以下物质可以通过化合反应及氧化还原反应制得的是( )
①FeCl2②FeCl3③Fe(OH)2④Fe(OH)3⑤CuS ⑥Al2S3.
①FeCl2②FeCl3③Fe(OH)2④Fe(OH)3⑤CuS ⑥Al2S3.
| A. | 全部 | B. | ①②③ | C. | ①②③④ | D. | ①②④⑥ |
1.下列属于电解质并能导电的物质是( )
| A. | 淀粉 | B. | KNO3 溶液 | C. | FeC13 晶体 | D. | 熔融的Na2O |
11.下列条件下,两瓶气体所含的原子数一定相等的是( )
①同质量不同密度的CO和N2②同温同体积的H2和Cl2
③同温同压同体积的N2和O2④同压同体积的N2O和CO2.
①同质量不同密度的CO和N2②同温同体积的H2和Cl2
③同温同压同体积的N2和O2④同压同体积的N2O和CO2.
| A. | ①③ | B. | ①② | C. | ②④ | D. | ③④ |
18.下列实验中,所选取的分离装置与对应原理都正确的是( )

| 选项 | 目的 | 装置 | 原理 |
| A | 氢氧化铁胶体的纯化 | ① | 胶体粒子不能通过滤纸,离子及小分子可以通过滤纸 |
| B | 分离苯中的溴苯 | ③ | 苯(0.88g/mL)和溴苯(1.5g/mL)的密度不同 |
| C | 粗盐提纯 | ② | NaCl在水中的溶解度很大 |
| D | 除去环己醇中的环己烯 | ④ | 环己醇的沸点(161℃)与环己烯的沸点(83℃)相差较大 |

| A. | A | B. | B | C. | C | D. | D |
15.X、Y、Z均为短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z-,Y+和Z-具有相同的电子层结构,下列说法正确的是( )
| A. | 原子最外层电子数:Z>Y>X | B. | 单质熔点:Y>Z>X | ||
| C. | 离子半径:X2->Z->Y+ | D. | 原子序数:X>Z>Y |
16.已知NO2能被水吸收,反应为3NO2+H2O═2HNO3+NO,在NO2被水吸收的反应中,发生还原反应和氧化反应的物质的质量比为( )
| A. | 3:1 | B. | 1:3 | C. | 1:2 | D. | 2:1 |